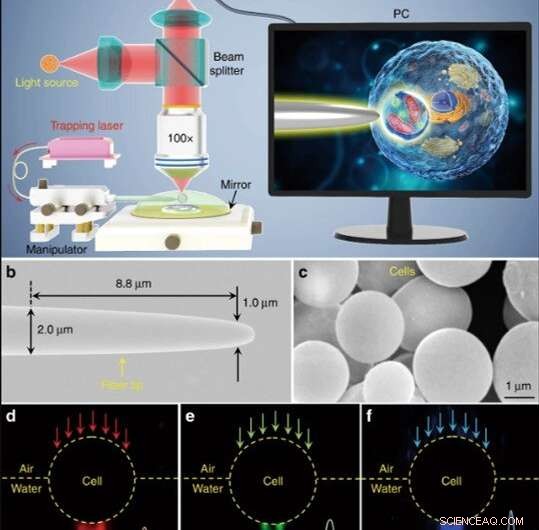
Illustrazione schematica e caratterizzazione dei materiali. (a) Illustrazione schematica del setup sperimentale. Per osservare i campioni e registrare le immagini è stato utilizzato un microscopio a riflessione convenzionale dotato di una fotocamera CCD e di un obiettivo da 100 ×. L'inserto mostrato sullo schermo di un PC raffigurante schematicamente come viene utilizzato il biomagnifier per ingrandire e visualizzare le strutture subcellulari all'interno di un biocampione. (b) Immagine SEM della punta della fibra con un diametro di 1.0 μm alla sua estremità rastremata. (c) Immagine SEM che mostra biomagnifier a base di cellule di lievito con superfici lisce e forme sferiche. d-f Immagini in campo scuro che mostrano luce rossa a 644 nm (d), luce verde a 532 nm (e), e luce blu da 473 nm (f) che trasmette attraverso il biomagnifier e viene focalizzata in punti luminosi a lunghezza d'onda inferiore con raggi della vita di 370, 300, e 270 nm, rispettivamente. Credito:Luce:scienza e applicazioni, doi:10.1038/s41377-019-0168-4
I microscopi ottici e le pinzette possono visualizzare e manipolare oggetti su microscala per applicazioni in biologia cellulare e molecolare. La risoluzione ottica è però, ostacolato dal limite di diffrazione e quindi sia i microscopi che le pinzette non sono in grado di visualizzare e manipolare direttamente i nano-oggetti. Le tecniche emergenti nei nanoscopi plasmonici/fotonici e nelle nanopinze mirano a raggiungere una risoluzione su scala nanometrica, sebbene le strutture dei materiali ad alto indice possano facilmente causare danni meccanici e fototermici ai campioni biologici su scala nanometrica.
In un recente studio ora pubblicato su Luce:scienza e applicazioni , Yuchao Li e colleghi dell'Istituto di nanofotonica in Cina, ha sviluppato un sistema di microscopio ottico utilizzando cellule viventi come minuscole lenti per visualizzare e manipolare oggetti più piccoli della lunghezza d'onda della luce. Hanno mostrato l'imaging del limite di diffrazione e la manipolazione di nano-oggetti con un dispositivo non invasivo, che hanno costruito intrappolando una cellula su una punta di fibra. La cellula intrappolata ha formato un biomagnifier in grado di ingrandire le nanostrutture con una risoluzione di 100 nm, al microscopio a luce bianca. Usando il biomagnifier, Li et al. formato una trappola nano-ottica per manipolare con precisione una singola nanoparticella con un raggio di 50 nm. La tecnica fornisce uno strumento di alta precisione per l'imaging ottico, rilevamento e assemblaggio di bio-nanomateriali senza danni meccanici o fototermici.
L'imaging ottico per manipolare piccoli oggetti è fondamentale per la diagnosi medica, rilevamento biologico, esplorazione cellulare, formazione molecolare e assemblaggio di materiali. Pinzette e microscopi sono dispositivi standard per l'imaging senza contatto e la manipolazione di campioni minuti che vanno da pochi nanometri a diversi micron. Tuttavia, è difficile utilizzare la tecnologia per immagini su scala nanometrica, poiché la risoluzione ottica è limitata a circa la metà della lunghezza d'onda di illuminazione.
Negli ultimi decenni, gli scienziati hanno compiuto notevoli progressi con i nanoscopi a campo vicino e le nanopinzette per ottenere l'imaging ottico con una risoluzione nanometrica. Queste tecniche di imaging sono state trattenute da materiali inorganici ad alto indice come metalli nobili e semiconduttori utilizzati per la loro fabbricazione, che possono danneggiare meccanicamente campioni di cellule o tessuti biologici durante l'imaging e la manipolazione in campo vicino.
Gli scienziati hanno quindi studiato schemi di imaging ottico più semplici basati su microsfere dielettriche per superare il limite di diffrazione comune ai microscopi convenzionali. Sebbene la tecnica sia priva di etichette e fattibile, tali microsfere sono basate su materiali inorganici artificiali come il biossido di silicio (SiO 2 ), biossido di titanio (TiO 2 ) e titanato di bario (BaTiO 3 ). I ricercatori sono quindi interessati allo sviluppo di un biomateriale naturale per costruire un dispositivo biocompatibile per il bioimaging, manipolazione e biomagnificazione a risoluzione spaziale su scala nanometrica.
(a) Illustrazione schematica del setup sperimentale. Per osservare i campioni e registrare le immagini è stato utilizzato un microscopio a riflessione convenzionale dotato di una fotocamera CCD e di un obiettivo da 100 ×. L'inserto mostrato sullo schermo di un PC raffigurante schematicamente come viene utilizzato il biomagnifier per ingrandire e visualizzare le strutture subcellulari all'interno di un biocampione. Credito:Luce:scienza e applicazioni, doi:10.1038/s41377-019-0168-4 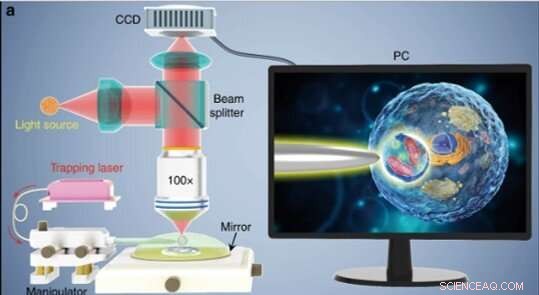
Gli scienziati hanno condotto tutti gli esperimenti sotto un microscopio ottico a riflessione accoppiato a una fotocamera con dispositivo ad accoppiamento di carica (CCD) e a un obiettivo. Hanno usato sorgenti luminose a 390 nm, 560 nm e 808 nm per l'eccitazione, rispettivamente l'illuminazione e l'intrappolamento. Utilizzando una fibra ottica con punta rastremata, Li et al. intrappolato il biomagnifier all'estremità della fibra, che controllavano muovendo la punta usando un micromanipolatore. Li et al. selezionate celle lisce e sferiche per ridurre al minimo l'aberrazione dell'immagine e notato che le celle mostrano migliori prestazioni di messa a fuoco quando semi-immerse in una soluzione per mantenere la vitalità cellulare.
Prestazioni di imaging sperimentale di diversi biomagnifier. (a) Diagramma schematico che mostra che il biomagnifier raccoglie le nanostrutture del campo vicino da un oggetto e forma un'immagine virtualmente ingrandita che può essere catturata da un microscopio ottico convenzionale. (b-e) Immagini ottiche di diversi biomagnifier costruiti da batteri (b), lievito (c), sangue rosso (d), e cellule staminali (e) parzialmente immerse nella sospensione cellulare. f Immagine SEM di una matrice di nanosfere di silice compatta esagonale bidimensionale assemblata mediante una tecnica di fotoferesi. (g-j) Immagini ottiche dell'array di nanosfere di silice ingrandite tramite biomagnifier basati su batteri (g), lievito (h), sangue rosso (i), e cellule staminali (j). (k) Immagine SEM della superficie di un reticolo di dischi Blu-ray con una larghezza della linea di 200 nm e una spaziatura di 100 nm. l–o Immagini ottiche della struttura del reticolo Blu-ray ingrandite tramite biomagnifier basati su batteri (l), lievito (m), sangue rosso (n), e cellule staminali (o). p Profilo di intensità lungo la linea tratteggiata lungo la struttura del reticolo Blu-ray indicata in o. q Puntini blu che mostrano il fattore di ingrandimento M delle immagini ottenute dai biomagnifier in funzione del diametro del biomagnifier. Credito:Luce:scienza e applicazioni, doi:10.1038/s41377-019-0168-4 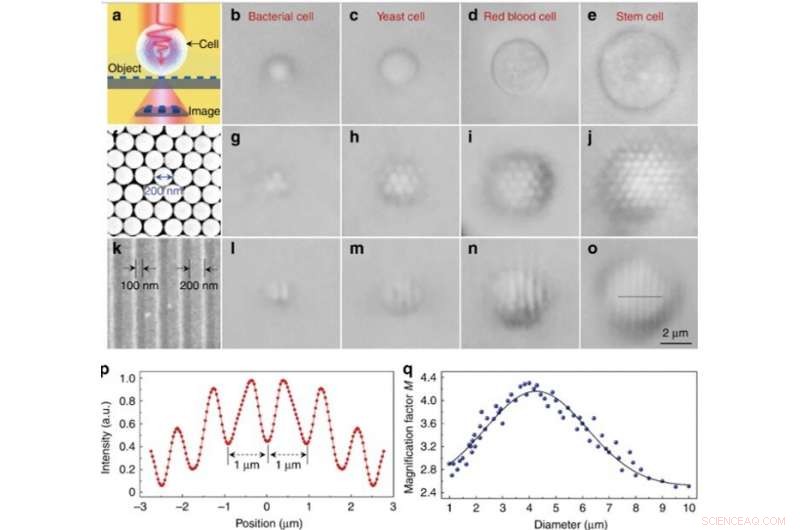
Solo le nanosfere con sopra dei biomagnificatori potrebbero essere risolte durante l'imaging, considerando che le nanosfere senza biomagnifier non potrebbero essere risolte utilizzando un microscopio convenzionale. Il fattore di ingrandimento M dei biomagnifier basati su cellule staminali è stato determinato essere 3,3 volte più grande (x3,3), e gli scienziati hanno mostrato che la M sperimentale dipendeva dal diametro del biomagnifier. Successivamente, Li et al. eseguito tutti gli esperimenti utilizzando biomagnifier di questo diametro.
Imaging nano-ottico di strutture subcellulari e lettere nanopatterned. (un, b) Immagini ottiche delle strutture subcellulari di una cellula epiteliale umana utilizzando un microscopio ottico convenzionale (a) e biomagnifier (b). Le posizioni di quattro biomagnifier sono contrassegnate come A–D. Per confronto, i biomagnifier possono risolvere il citoscheletro fibroso (indicato come A–C) all'interno della cellula e le strutture a due strati (indicate come D) sulla membrana cellulare, che sono indistinguibili dal microscopio convenzionale. c–e SEM (c), campo oscuro (d), e immagini ottiche (e) di lettere nanomodellate JNU che rappresentano l'acronimo di Jinan University. La larghezza della linea delle lettere nanomodellate è 100 nm, che è inferiore alla risoluzione limite di diffrazione del microscopio ottico convenzionale. f–h Immagini ottiche che mostrano che il biomagnifier intrappolato sulla punta della fibra può scansionare e visualizzare le lettere nanomodellate J (f), N (g), e U (h) spostando la fibra. La larghezza della linea delle lettere nanomodellate è stata ingrandita da 100 a 400 nm. Credito:Luce:scienza e applicazioni, doi:10.1038/s41377-019-0168-4 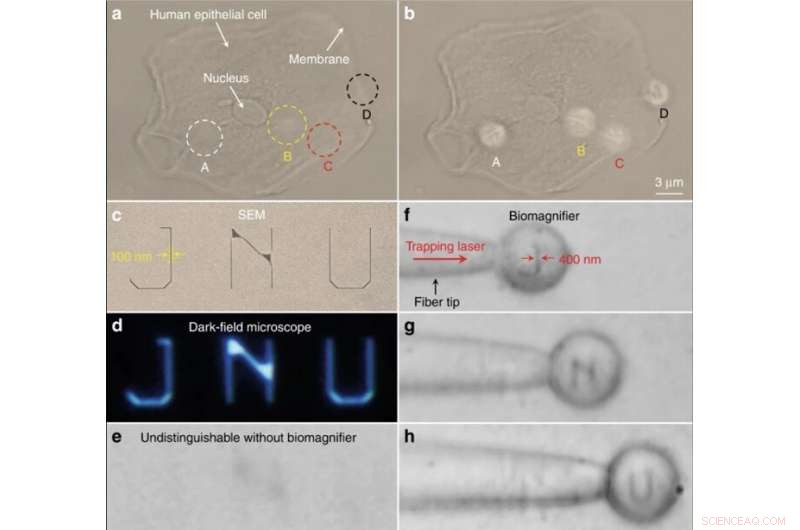
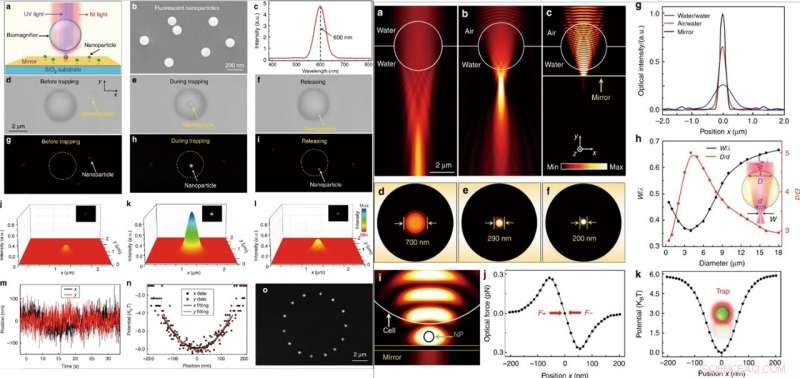
A SINISTRA:Manipolazione ottica di una singola nanoparticella fluorescente. (a) Diagramma schematico che mostra una nanoparticella fluorescente sospesa sulla superficie di uno specchio e intrappolata dal biomagnifier. (b) Immagine SEM che mostra le nanoparticelle fluorescenti PS con un raggio medio di 50 nm. (c) Spettro di emissione che mostra la lunghezza d'onda di emissione centrale delle nanoparticelle fluorescenti situate a 600 nm. (d–f) Le immagini ottiche mostrano il processo di intrappolamento di una singola nanoparticella PS con il biomagnifier. Il processo consisteva in tre fasi successive:prima della cattura (d), durante la cattura (e), e dopo il rilascio (f). g–i Immagini di fluorescenza che mostrano il punto di fluorescenza della nanoparticella PS prima di essere intrappolata (g), durante la cattura (h), e dopo il rilascio (i). j–l Mappatura cromatica tridimensionale delle macchie di fluorescenza della nanoparticella come mostrato in g–i. m Traccia in tempo reale della posizione della nanoparticella intrappolata nelle direzioni x e y. (n) Potenziale di intrappolamento della nanoparticella intrappolata nelle direzioni x e y con raccordi a parabola. (o) Le immagini composite di fluorescenza mostrano la traccia di movimento della nanoparticella intrappolata nel piano x–y mediante il movimento controllato del biomagnifier. A DESTRA:Simulazione numerica e calcolo. (a-c) Distribuzioni dell'intensità ottica della luce focalizzata da un biomagnifier da 4 μm completamente immerso nell'acqua (a), semi-immerso in acqua (b), e sospeso sulla superficie di uno specchio (c). La sorgente luminosa di illuminazione è stata impostata come un raggio gaussiano con una lunghezza d'onda di 560 nm. (d–f) Distribuzioni dell'intensità ottica dei punti luminosi dal biomagnifier corrispondente a (a–c) nel piano x–z. (g) Profili di intensità ottica sui piani focali della luce in uscita dai biomagnifier nella direzione x. (h) Risultati della simulazione FEM per la vita normalizzata del punto luminoso w/λ (w è il raggio della vita del punto luminoso e è la lunghezza d'onda della luce in ingresso) e il rapporto D/d (la larghezza della regione lineare dove la luce entra nel biomagnifier sulla sua superficie anteriore è indicato come D, e la larghezza del raggio di luce in uscita sulla superficie posteriore è (d) in funzione del diametro del biomagnifier. (i) Distribuzione dell'intensità simulata della luce di intrappolamento del vicino infrarosso che mostra che una nanoparticella (raggio:50 nm) è intrappolata nello spazio tra il biomagnifier e lo specchio. La potenza ottica in ingresso della luce di intrappolamento è stata impostata su 10 mW. (j) Forze ottiche simulate della nanoparticella intrappolata nel punto luminoso in funzione della posizione della nanoparticella lungo la direzione x. (k) Potenziale di intrappolamento calcolato della nanoparticella intrappolata in funzione della posizione lungo la direzione x. Credito:Luce:scienza e applicazioni, doi:10.1038/s41377-019-0168-4
Successivamente, quando hanno irradiato simultaneamente raggi laser nel vicino infrarosso (IR) e UV sul biomagnifier attraverso una lente dell'obiettivo, potrebbero intrappolare ed eccitare le nanoparticelle. Per questi esperimenti, gli scienziati hanno utilizzato nanoparticelle fluorescenti con un raggio medio di 50 nm. Quando hanno intrappolato una singola nanoparticella nel fuoco di un biomagnifier, hanno osservato immagini sia ottiche che fluorescenti del campione di interesse. Li et al. quindi calcolato la rigidità di intrappolamento della particella in tempo reale utilizzando pinzette ottiche standard. La capacità di manipolare una singola nanoparticella senza contatto e precisamente tramite l'ottica sarà utile per assemblare nanostrutture ben regolate. Quando Li et al. ha studiato numericamente il meccanismo di imaging e la rigidità di intrappolamento dei biomagnifier utilizzando la simulazione 3D e il software COMSOL. Hanno osservato che la capacità di focalizzazione della luce al limite della subdiffrazione risultava da un effetto combinato di "nanojet fotonico" e dal miglioramento dell'interferenza coerente da parte dello specchio.
I limiti del metodo includevano l'aberrazione e la distorsione dell'immagine dovute alle strutture intracellulari disomogenee del biomagnifier naturale, rispetto alle microsfere dielettriche con indici di rifrazione uniformi. Fortunatamente, i materiali intracellulari erano otticamente trasparenti alla luce visibile e al vicino infrarosso e le interazioni ottiche erano relativamente deboli all'interno di una singola cellula. Le attività intracellulari potrebbero anche modificare la distribuzione parziale dell'indice di rifrazione in una cellula per causare la distorsione della luce durante l'intrappolamento e l'imaging, ma la maggior parte delle attività intracellulari erano ultraveloci e non influenzavano lo schema di imaging.
In questo modo, Yuchao Li e colleghi hanno sviluppato una nuova tecnica di imaging sperimentale e hanno verificato le capacità sperimentali con simulazioni FEM. Li et al. nanoscopi ottici e nanopinzette integrati in un unico dispositivo per l'immagine e la manipolazione simultanea di nanostrutture per la prima volta nel presente lavoro. Hanno promosso la risoluzione della tecnica a 100 nm e proposto una procedura di imaging senza etichetta. Gli scienziati immaginano il biomagnifier vivente per aprire nuove opportunità nell'imaging a super risoluzione, rilevamento in tempo reale e nanoassemblaggio preciso di bionanomateriali per formare nanoarchitetture di interesse.
© 2019 Scienza X Rete