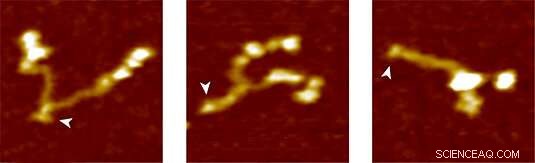
Proteina del fattore di von Willebrand:completamente aperta (a sinistra), parzialmente chiuso e completamente chiuso (a destra). Credito:Gruppo Lipfert
I fisici della LMU hanno sviluppato un metodo altamente sensibile per misurare la stabilità meccanica delle conformazioni proteiche, e lo usava per monitorare i primi passi nella formazione di coaguli di sangue.
Come mediatori centrali della funzione cellulare negli organismi biologici, le proteine sono coinvolte nell'esecuzione di quasi tutti i processi cellulari. Forniscono l'impalcatura interna che conferisce alle cellule la loro forma, e consentono alle cellule di alterare dinamicamente la loro morfologia. Trasportano i substrati avanti e indietro attraverso le membrane, e catalizzano la maggior parte delle reazioni chimiche che avvengono nelle cellule. Nel corso di questi compiti molte proteine sono soggette a forze esterne. Infatti, alcune proteine "meccanosensibili" misurano efficacemente la forza delle forze che agiscono su di esse e si attivano quando la forza imposta supera un determinato valore di soglia. Fattore di von Willebrand (VWF), che avvia la formazione di coaguli di sangue, è un importante rappresentante di questa classe.
Le forze meccaniche necessarie per attivare proteine come il VWF sono spesso così piccole che non è stato possibile determinarne l'entità utilizzando i metodi esistenti. Ora, un team di scienziati guidati dai fisici della LMU, il dott. Martin Benoit e il professor Jan Lipfert, ha sviluppato una procedura molto più sensibile. Le loro "pinzette magnetiche" possono quantificare forze 100 volte inferiori rispetto al metodo alternativo comunemente usato attualmente disponibile. Come riportano Lipfert e colleghi sulla rivista PNAS , hanno impiegato la tecnica per osservare il dispiegamento della proteina VWF sotto l'influenza di basse forze meccaniche.
Un potente approccio per studiare la meccanoregolazione è la cosiddetta spettroscopia a forza proteica. Si tratta di tirare su una singola molecola proteica e osservare come una forza applicata altera la sua struttura tridimensionale. Fino ad ora, il metodo scelto per tirare è stato un microscopio a forza atomica, che funziona meglio nell'intervallo di 100 piconewton (pN). "Però, molti processi molecolari sono attivati da forze molto più deboli di quella, " dice Lipfert. "Quindi per le misurazioni a livello di singole molecole, abbiamo bisogno di una strumentazione più sensibile:non ha molto senso usare una bilancia da bagno per pesare gli ingredienti di una torta".
I ricercatori hanno sviluppato un metodo in cui le proteine sono attaccate a un'estremità a una superficie di vetro e portano un'etichetta all'altra estremità che si lega a minuscole perline magnetiche e l'assemblaggio viene quindi sottoposto a un campo magnetico esterno. L'estensione della proteina indotta dal campo determina lo spostamento verticale di ciascuna biglia, che può essere rilevato al microscopio. "Questo tipo di set-up è indicato come pinzette magnetiche, "Spiega Lipfert. "Ha il grande vantaggio che ci permette di applicare e risolvere forze molto deboli, significativamente inferiori a 1 piconewton, alla proteina di interesse. Inoltre, le pinzette magnetiche consentono misurazioni molto stabili per lunghi periodi di tempo, fino a una settimana."
Per testare il nuovo metodo, il gruppo LMU ha utilizzato il VWF come proteina bersaglio. Nel flusso sanguigno, Il VWF circola come multimero di dimeri formati da due subunità identiche. In condizioni normali di flusso sanguigno, ha una forma globulare relativamente compatta. Però, qualsiasi aumento delle forze di taglio nel flusso sanguigno a causa di una lesione del sistema vascolare provoca lo sviluppo del vWF. Ciò espone i siti di legame per i recettori sulle piastrine del sangue. Il legame del VWF alle piastrine a sua volta innesca una cascata di reazioni che porta alla coagulazione, che sigilla la ferita. "La cascata è indotta dall'azione sulla molecola di forze meccaniche agenti molto più deboli di quelle finora misurate, " dice Lipfert. L'analisi della decompressione dei dimeri VWF con pinzette magnetiche ha mostrato che il cosiddetto gambo VWF si apre sotto una forza applicata inferiore a 1 pN, quando le subunità del dimero vengono separate come le due metà di una cerniera. "Supponiamo che questo modello di comportamento, che abbiamo potuto osservare per la prima volta, rappresenta il primo passo nella coagulazione del sangue, " afferma Lipfert. "Il nostro approccio fornisce un quadro dettagliato delle forze e dei cambiamenti nell'estensione coinvolti nello sviluppo della proteina. Siamo fiduciosi che la futura applicazione del metodo contribuirà a una migliore comprensione della modalità d'azione del VWF e del ruolo delle mutazioni clinicamente rilevanti.