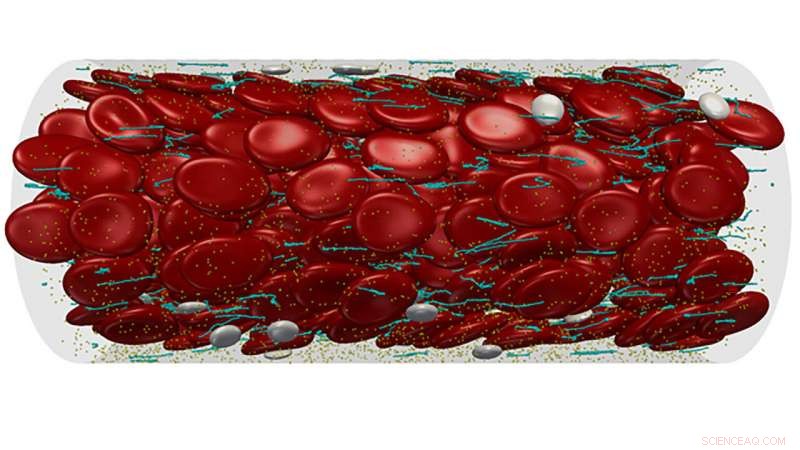
I ricercatori esaminano il lavoro recente sulla comprensione del comportamento del fattore con Willebrand nella bioingegneria APL, dipingere un ritratto di vWF, e mettendo in evidenza i progressi nel campo, gli autori hanno proposto strade promettenti per le terapie nel controllo di queste proteine. Modellazione multiscala del flusso sanguigno complesso attraverso un microvaso. Attestazione:Zixiang Liu
I coaguli di sangue sono stati a lungo implicati in infarti e ictus, insieme rappresentano quasi la metà dei decessi ogni anno negli Stati Uniti. Mentre il ruolo di una proteina chiave nel processo, chiamato fattore di von Willebrand, è stato stabilito, un modello affidabile per prevedere come il vWF si accumula nei vasi sanguigni rimane sfuggente.
I ricercatori del Georgia Institute of Technology hanno pubblicato una recensione di recenti lavori sulla comprensione del comportamento del vWF in APL Bioingegneria . La carta dipinge un ritratto di vWF, che si srotola sotto lo sforzo di taglio del flusso sanguigno per formare reti che intrappolano le piastrine che passano, che poi formano un coagulo di sangue, chiamato trombo. Evidenziando i progressi nel campo, gli autori hanno proposto strade promettenti per le terapie nel controllo di queste proteine.
"Il trombo deve bloccare il flusso sanguigno mentre si chiude, come cercare di usare il pollice all'estremità di un tubo da giardino e poi fermare tutto il flusso con un po' di fango, " ha detto David Ku, un autore sulla carta. "Questo è estremamente difficile da realizzare, quindi la trombosi richiede il più veloce, legami più forti in tutta la biologia."
Una sfida è che molti dei modelli sperimentali odierni possono solo visualizzare eventi sulla scala dei micron ogni secondo o giù di lì. proteine vWF, però, sono circa un millesimo di quella dimensione, e le loro interazioni si verificano in un millesimo di quel tempo.
Una varietà di modelli informatici è stata proposta per colmare il divario dalla microscala alla nanoscala nella formazione di coaguli, che vanno dalle simulazioni basate sul tempo necessario per la formazione dei coaguli a modelli computazionalmente intensivi che ricreano come le piastrine, Il vWF e le cellule interagiscono tutti nel flusso sanguigno. Il documento invita i ricercatori di tutta la biologia, informatica e altre aree per collaborare per costruire un modello migliorato.
Oltre a prendere di mira l'aggregazione piastrinica e gli ambienti ad alto taglio che estendono il vWF, una potenziale terapia è quella di potenziare l'attività di un'altra proteina, ADAMTS13, che scinde il vWF e lo rende incapace di formare coaguli. Mentre la ricerca sui modelli murini mostra risultati promettenti, è ancora necessario molto lavoro per determinare se le terapie ADAMTS13 sarebbero sicure o efficaci per gli esseri umani.
La stessa ricerca di Ku ha indicato le nanoparticelle caricate negativamente che la modellazione computazionale ha dimostrato potrebbero mantenere il vWF nel suo stato non reattivo arrotolato. Il gruppo ha scoperto che le nanoparticelle riducono la velocità di occlusione dei vasi e stanno esplorando come spiegare e ottimizzare questo processo.
Ku ha detto che spera che il documento possa ispirare gli altri ad approfondire nuovi modi di misurare e comprendere il vWF che forma il coagulo.