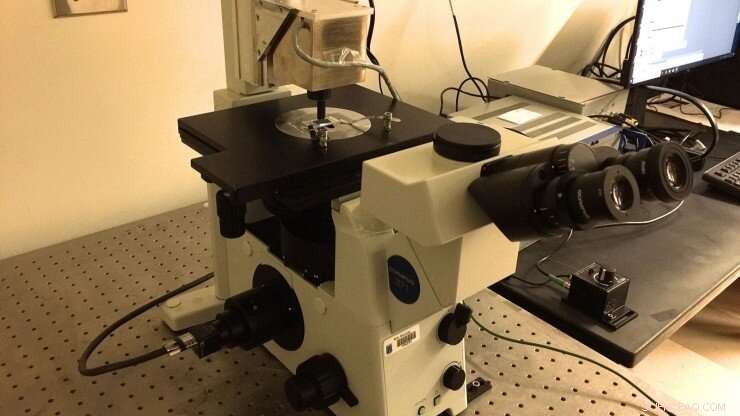
La nuova configurazione delle pinzette magnetiche del laboratorio Marszalek, che è stato costruito secondo le specifiche condivise dal professor Julio Fernandez (Columbia University). Una camera microfluidica funzionalizzata con "pennelli" poliproteici viene ripresa utilizzando un obiettivo ad olio ad immersione che alimenta una telecamera CMOS. Le sfere magnetiche sono attaccate alle poliproteine per esercitare su di esse forze di piconewton regolando la posizione dei magneti permanenti al neodimio 52. I magneti vengono manipolati utilizzando un dispositivo PID posizionato sopra la camera. Credito:Duke University
Per quanto riguarda l'organizzazione dello spazio, Il DNA ha poteri che rivaleggiano con Marie Kondo. Un filamento di DNA lungo due metri si ripiega in modo intricato in un nucleo cellulare di soli 10 micron di diametro. (Uno dei capelli sulla tua testa ha un diametro di 100 micron, e non puoi vedere niente di più piccolo senza un microscopio.) Tutto ciò che deve accadere biochimicamente affinché il DNA funzioni dipende dal preciso disimballaggio e svolgimento dei suoi filamenti da quel minuscolo spazio.
Ma lo studio del DNA e di altre molecole complesse spesso si concentra non sulle loro proprietà meccaniche ma sui loro processi chimici, ha osservato il professore di ingegneria meccanica e scienza dei materiali di Duke Piotr Marszalek. Mentre la ricerca biochimica ha portato ad applicazioni rivoluzionarie come la clonazione, terapia genica e profili di espressione genica, Marszalek ha affermato che l'intensa attenzione alla singola area ha talvolta messo in ombra l'importanza della meccanica nella comprensione della relazione tra struttura molecolare e funzione.
Marszalek appartiene a una comunità di ricercatori che utilizzano la spettroscopia di forza a singola molecola (SMFS) per studiare la struttura molecolare, e le forze che stabilizzano queste strutture. Attualmente, ci sono tre approcci principali a SMFS:microscopia a forza atomica (AFM), che scansiona la superficie di una molecola con una sonda delle dimensioni di pochi atomi ed è in grado di allungare meccanicamente queste molecole; pinzette ottiche, che attraggono le particelle tramite laser focalizzati (e che hanno fatto guadagnare al loro inventore, Arthur Ashkin, un premio Nobel per la fisica); e pinzette magnetiche, la cui attrazione è così potente che Marszalek mi ha messo in guardia dal maneggiarli, per paura che la mia pelle venisse pizzicata tra i cilindri magnetici e che non riuscissi a staccarli.
Ogni approccio consente ai ricercatori di catturare una singola molecola, come il DNA, o un po' di muscolo o altre proteine e allungatelo lentamente per osservare cosa succede.
Non si spezza solo a metà, come potresti aspettarti.
Le catene polipeptidiche sono piegate localmente, Marszalek ha spiegato, in modo da formare piccoli globuli. "Quando inizialmente allunghi una proteina, fai una struttura dritta, " disse. "Ma quando tiri più lontano, tutto comincia a rilassarsi. Puoi tirare e tirare senza rompere, e in casi estremi un dominio può disfarsi e offrire una lunghezza extra per proteggersi."
Marszalek ha sottolineato che questa non è una novità:nel maggio 1997, tre articoli su questo argomento sono stati pubblicati quasi contemporaneamente, uno in Natura (Il team di Robert Simmons ha usato pinzette ottiche) e due in Scienza (Il team di Carlos Bustamante ha utilizzato anche pinzette ottiche, mentre il team di Herman Gaub usava l'AFM). Ma quelle scoperte hanno insegnato molto ai ricercatori su come viene costruito il muscolo, e rafforzare l'importanza di comprendere la meccanica alla scala più piccola.
Marszalek attualmente lavora per capire come le molecole recuperano le loro forme e funzionano una volta che la tensione esercitata su di esse si è allentata. Prendi la luciferasi di lucciola:quando piegata correttamente, questa proteina bioluminesce. Quando perde la sua struttura, diventa un semplice polimero, incapace di produrre luce. Altre proteine, nello stesso punto di crollo, beneficiare dell'assistenza di "enzimi chaperonizzati" che aiutano nel recupero della loro forma originale. Come lo fanno, Esattamente, non è chiaro, e saperne di più su quel meccanismo potrebbe dare un'idea di come i nostri corpi guariscono dopo lo stress fisico.
Alcuni dei colleghi di Marszalek stanno elaborando i meccanismi delle infezioni batteriche:come batteri come lo stafilococco sono in grado di rilevare le proteine recettrici nelle cellule e si attaccano a esse in modo così tenace che il flusso sanguigno non è in grado di lavarle via. La forza di tale legame è stata misurata con successo nel 2017 utilizzando AFM, e scoprire come sciogliere i legami potrebbe aiutare nella lotta contro tali infezioni mortali.
Alla fine dell'estate 2019, la National Science Foundation ha finanziato un workshop SMFS organizzato da Marszalek, insieme ad Andres F. Oberhauser dell'Università del Texas Medical Branch. Tenuto al Duca, il workshop ha riunito i luminari che hanno aperto la strada alle tecniche SMFS decenni fa con ricercatori junior che si sono concentrati sulle prospettive future della spettroscopia di forza. L'intensa agenda di sessioni e tavole rotonde si è protratta ogni giorno fino alle ore serali, man mano che i partecipanti coprivano i principali risultati consentiti da ciascuna tecnica, proposte direzioni future, e rimuginato su blocchi stradali che impediscono ulteriori progressi.
Era anche, come Marszalek aveva sperato, un incontro di scambio per strumenti e idee. I ricercatori dell'Università del Colorado-Boulder hanno offerto molecole che possono essere utilizzate come "maniglie" per separare altre molecole; un ricercatore della Johns Hopkins ha dimostrato come le pinzette laser possono essere utilizzate per catturare le proteine appena sintetizzate. Lo stesso Marszalek se ne è andato con una nuova brillante collaborazione con l'Università di Milwaukee, i cui fisici hanno una profonda esperienza con le pinzette magnetiche.
"La spettroscopia di forza a singola molecola è chiaramente diventata maggiorenne e ha prodotto molte scoperte seminali nei campi della meccanobiologia e della meccanochimica, " ha affermato Marszalek. "L'entusiasmo per gli approcci SMFS è in costante aumento, ma ci sono sfide da risolvere, in particolare quando si tratta di sfruttare SMFS per studiare le proprietà meccaniche e le forze all'interno delle cellule viventi. Man mano che i ricercatori sviluppano approcci intelligenti per raggiungere tale obiettivo, questo argomento da solo potrebbe essere il tema di un altro entusiasmante simposio."