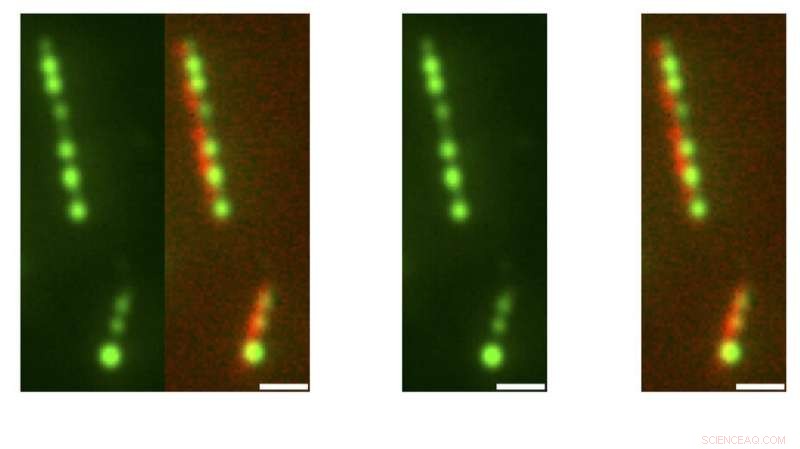
I ricercatori nei laboratori degli scienziati dell'Università di Princeton Joshua Shaevitz, Howard Stone, e Sabine Petry hanno scoperto che la tensione superficiale spinge la proteina simile al liquido TPX2 a formare globuli che nucleano la formazione di microtubuli ramificati durante la divisione cellulare. Il documento che descrive in dettaglio queste scoperte è apparso nel numero del 28 gennaio della rivista Fisica della natura . Qui, Sfere TPX2 (verdi) su microtubuli (rosse) in micrografie, con una barra di scala di un micron. Credito:Sagar U. Setru, Bernardo Gouveia, Raymundo Alfaro-Aco, Joshua W. Shaevitz, Howard A. Stone e Sabine Petry
Come ogni cuoco sa, alcuni liquidi si mescolano bene tra loro, ma altri no. Per esempio, quando un cucchiaio di aceto viene versato nell'acqua, basta una breve agitazione per far amalgamare bene i due liquidi. Però, un cucchiaio di olio versato nell'acqua si fonderà in goccioline che nessuna quantità di agitazione può dissolvere. La fisica che governa la miscelazione dei liquidi non si limita alle scodelle; influenza anche il comportamento delle cose all'interno delle cellule. È noto da diversi anni che alcune proteine si comportano come liquidi, e che alcune proteine liquide non si mescolano. Però, si sa molto poco su come queste proteine simili a liquidi si comportano sulle superfici cellulari.
"La separazione tra due liquidi che non si mescolano, come olio e acqua, è noto come "separazione di fase liquido-liquido", ed è fondamentale per la funzione di molte proteine, " disse Sagar Setru, un dottorato di ricerca 2021 laureato che ha lavorato sia con Sabine Petry, professore di biologia molecolare, e Joshua Shaevitz, un professore di fisica e il Lewis-Sigler Institute for Integrative Genomics.
Tali proteine non si dissolvono all'interno della cellula. Anziché, si condensano con se stessi o con un numero limitato di altre proteine, consentendo alle cellule di compartimentare determinate attività biochimiche senza doverle avvolgere all'interno di spazi delimitati dalla membrana.
"Nella biologia molecolare, lo studio delle proteine che formano fasi condensate con proprietà liquide è un campo in rapida crescita, " disse Bernardo Gouveia, uno studente laureato in ingegneria chimica e biologica, lavorando con Howard Stone, il Donald R. Dixon '69 e Elizabeth W. Dixon Professore di ingegneria meccanica e aerospaziale, e presidente del dipartimento. Setru e Gouveia hanno collaborato come co-primi autori nel tentativo di comprendere meglio una di queste proteine.
"Eravamo curiosi del comportamento della proteina liquida TPX2. Ciò che rende speciale questa proteina è che non forma goccioline liquide nel citoplasma come era stato osservato prima, ma sembra invece subire la separazione di fase su polimeri biologici detti microtubuli, " ha detto Setru. "TPX2 è necessario per creare reti ramificate di microtubuli, fondamentale per la divisione cellulare. TPX2 è anche sovraespresso in alcuni tumori, quindi comprendere il suo comportamento può avere rilevanza medica".
I singoli microtubuli sono filamenti lineari a forma di bastoncello. Durante la divisione cellulare, nuovi microtubuli si formano ai lati di quelli esistenti per creare una rete ramificata. I siti in cui cresceranno nuovi microtubuli sono contrassegnati da globuli di TPX2 condensato. Questi globuli TPX2 reclutano altre proteine necessarie per generare la crescita dei microtubuli.
I ricercatori erano curiosi di sapere come si formano i globuli TPX2 su un microtubulo. Per scoprirlo, decisero di provare a osservare il processo in azione. Primo, hanno modificato i microtubuli e il TPX2 in modo che ciascuno si illuminasse di un diverso colore fluorescente. Prossimo, hanno posizionato i microtubuli su un vetrino da microscopio, aggiunto TPX2, e poi guardato per vedere cosa sarebbe successo. Hanno anche effettuato osservazioni ad altissima risoluzione spaziale utilizzando un potente approccio di imaging chiamato microscopia a forza atomica.
"Abbiamo scoperto che TPX2 prima ricopre l'intero microtubulo e poi si rompe in goccioline che sono uniformemente distanziate tra loro, simile a come la rugiada mattutina ricopre una ragnatela e si scompone in goccioline, " disse Gouveia.
Setru, Gouveia e colleghi hanno scoperto che ciò si verifica a causa di qualcosa che i fisici chiamano instabilità di Rayleigh-Plateau. Sebbene i non fisici possano non riconoscere il nome, conosceranno già il fenomeno, il che spiega perché un flusso d'acqua che cade da un rubinetto si scompone in goccioline, e perché uno strato uniforme di acqua su un filo di ragnatela si fonde in perline separate.
"È sorprendente trovare una fisica così quotidiana nel mondo su scala nanometrica della biologia molecolare, " disse Gouveia.
Estendendo il loro studio, i ricercatori hanno scoperto che la spaziatura e la dimensione dei globuli TPX2 su un microtubulo è determinata dallo spessore del rivestimento TPX2 iniziale, ovvero quanto TPX2 è presente. Questo potrebbe spiegare perché la ramificazione dei microtubuli è alterata nelle cellule tumorali che sovraesprimono TPX2.
"Abbiamo usato simulazioni per dimostrare che queste goccioline sono un modo più efficiente per creare rami rispetto al semplice rivestimento o legame uniforme della proteina lungo tutto il microtubulo, " disse Setru.
"Che la fisica della formazione delle goccioline, così vividamente visibile ad occhio nudo, ha un ruolo da svolgere alle scale micrometriche, aiuta a stabilire l'interfaccia crescente (nessun gioco di parole) tra la fisica della materia soffice e la biologia, " ha detto Rohit Pappu, l'Edwin H. Murty Professor of Engineering alla Washington University di St. Louis, che non è stato coinvolto nello studio.
"È probabile che la teoria sottostante sia applicabile a un assortimento di interfacce tra condensati simili a liquidi e superfici cellulari, " aggiunge Pappu. "Ho il sospetto che torneremo su questo lavoro ancora e ancora".