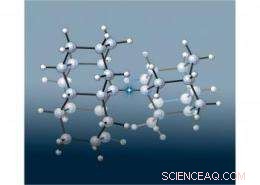
Un team di scienziati europei e SLAC ha unito due minuscole strutture "diamante" simili a diamanti per creare il legame carbonio-carbonio più lungo (evidenziato in questa immagine dalla stella) mai visto in un alcano, una classe di molecole formate solo da carbonio e idrogeno collegate da singoli legami covalenti. Ciò che è stato sorprendente, però, era che la molecola era molto più stabile di quanto ci si aspettasse, poiché i legami più lunghi sono generalmente più deboli. I ricercatori hanno determinato che le forze attrattive tra i diamondoidi migliorano la stabilità di questa molecola. Immagine di Peter R. Schreiner, Università Justus Liebig, Germania.
(PhysOrg.com) -- La forza di un legame chimico tra gli atomi è la base fondamentale per la stabilità e la reattività di una molecola. La regolazione della forza e dell'accessibilità del legame può modificare drasticamente le proprietà di una molecola. Per esempio, la forza di un legame è direttamente correlata alla sua lunghezza:allungare un legame oltre la sua lunghezza normale lo rende più debole.
Ma una nuova ricerca di un team di due università europee e dello SLAC National Accelerator Laboratory mostra che le forze attrattive tra altre parti di una molecola possono rendere un legame allungato che unisce due atomi di carbonio molto più stabile del previsto. Questo risultato dovrebbe portare a miglioramenti nel modo in cui gli scienziati progettano nuove molecole, materiali e catalizzatori.
“Forniamo una comprensione del motivo per cui le molecole con legami eccezionalmente lunghi non devono necessariamente essere instabili, "ha detto Jeremy Dahl, uno scienziato dello Stanford Institute for Materials &Energy Science (SIMES), un istituto gestito congiuntamente da SLAC e dalla Stanford University. I collaboratori erano Peter R. Schreiner dell'Università Justus-Liebig in Germania e Andrey A. Fokin dell'Istituto Politecnico di Kiev in Ucraina. I risultati sono pubblicati oggi in Natura .
Sebbene applicabile a tutti i tipi di molecole, la nuova ricerca coinvolge gli alcani, una classe di molecole composte solo da atomi di carbonio e idrogeno collegati da singoli legami covalenti, e diamantini, che sono diamanti delle dimensioni di una molecola introdotti dai ricercatori SIMES. Etano, propano e ottano sono alcani familiari che hanno la spina dorsale di due, tre e otto atomi di carbonio, rispettivamente, tutti uniti da singoli legami. Gli atomi di carbonio nei diamondoidi estremamente rigidi sono disposti nella stessa forma tetraedrica del diamante.
Nella loro nuova ricerca, gli scienziati hanno unito coppie di diamanti per creare tre nuovi alcani che avevano un legame carbonio-carbonio ultra lungo nel mezzo. Per accogliere gli ingombranti diamondoidi, il legame centrale doveva allungarsi ben oltre la normale lunghezza del legame carbonio-carbonio di 1,54 angstrom. (Un angstrom, o , è un decimo di nanometro.) Una delle nuove molecole aveva il legame carbonio-carbonio più lungo mai misurato in un alcano:1.704Å.
Sorprendentemente, queste nuove molecole a doppio diamante si sono rivelate molto più stabili del previsto. Ricerche precedenti di altri gruppi avevano dimostrato che un alcano con un legame carbonio-carbonio di 1,65Å sopravviveva meno di un'ora a 167C (333F). In contrasto, il legame centrale carbonio-carbonio in due delle nuove molecole di diamante collegate si è rotto solo dopo essere stato riscaldato sopra i 300°C (572F). Il terzo, con il legame carbonio-carbonio 1.704Å, è durato fino a quando non è stato riscaldato a 220 ° C (428 ° F).
“Sulla base della sola lunghezza del legame carbonio-carbonio, Mi aspettavo che queste molecole di diamante fossero molto meno stabili di quanto si sono dimostrate, Schreiner ha detto. "Qualcos'altro doveva succedere per tenere insieme queste nuove molecole".
Cosa ha fatto la differenza? struttura cristallina a raggi X, risonanza magnetica nucleare, e gli studi termogravimetrici fatti dai colleghi europei di Dahl hanno mostrato che anche se i legami si allungavano, le forze attrattive tra i due diamondoidi li stavano avvicinando l'uno all'altro. Queste forze attrattive si vedono solitamente tra molecole separate, dove sono chiamate forze di van der Waals dal fisico olandese che per primo le descrisse nel 1873. “Gli scienziati di solito non considerano le attrazioni di van der Waals quando analizzano la stabilità di una singola molecola, ma ora sembra che dovrebbero, "Dal ha detto.
I risultati della ricerca del gruppo sono stati supportati da calcoli sofisticati che hanno permesso agli scienziati di attivare e disattivare le forze attrattive quando hanno valutato le stabilità delle nuove molecole.
Schreiner ha aggiunto che questa scoperta potrebbe spiegare perché l'analisi convenzionale prevede che gli alcani ramificati - che contengono grandi gruppi di atomi attaccati alla struttura degli alcani - siano molto meno stabili di quanto non siano in realtà, e perché i diamondoidi hanno punti di fusione molto più alti del previsto.
Questi risultati sono gli ultimi di una serie di interessanti risultati di ricerca e applicazioni per i diamondoidi da quando Dahl e il suo collega Robert Carlson hanno sviluppato un modo per isolarne quantità significative dal petrolio greggio nel 2003.
Tra le loro interessanti proprietà, i diamondoidi emettono elettroni in modo estremamente efficiente. In un lavoro pubblicato su Science nel 2007, scienziati SIMES Zhi-Xun Shen, Wanli Yang e Nick Melosh – oltre a Dahl, Carlson e il gruppo Schreiner - hanno dimostrato che i diamondoidi emettono facilmente elettroni in un intervallo di energia molto ristretto, una proprietà che potrebbe migliorare le capacità di imaging di diversi tipi di microscopi elettronici, nonché la configurazione del fascio di elettroni utilizzata per realizzare chip per computer.
I diamantini sono anche altamente personalizzabili, il che significa che diverse varietà possono essere prodotte e modificate per soddisfare diverse specifiche:cristalli tridimensionali per applicazioni che richiedono un materiale in polvere, film bidimensionali per il rivestimento di altri materiali, e forse anche nanofili unidimensionali per il trasferimento di carica o luce.
“Questi ultimi risultati mostrano che produrre molecole in nuove forme e dimensioni può portare a scoperte sorprendenti, "Dal ha detto.