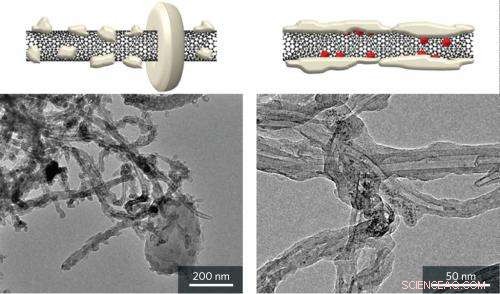
Viste schematiche (in alto) e immagini di microscopia elettronica a trasmissione (in basso) che mostrano cristalli rigidi che si formano su nanotubi di carbonio nudi (a sinistra) e depositi amorfi su catodi di nanotubi di carbonio con nanoparticelle di ossido di rutenio (RuO2) (a destra) dopo lo scarico di litio-ossigeno (Li –O2) batterie. Credito:riprodotto, con permesso, dal Rif. 1 © 2013 American Chemical Society
Litio-ossigeno non acquoso (Li-O 2 ) le batterie potrebbero immagazzinare energia a densità che rivaleggiano con la benzina. Commercializzando questa tecnologia emergente, però, richiederanno innovazioni che consentiranno di ricaricare le batterie in modo efficiente. Hye Ryung Byon e Eda Yilmaz della RIKEN Byon Initiative Research Unit hanno compiuto un grande passo avanti verso questo obiettivo migliorando significativamente l'efficienza di ricarica di Li–O 2 batterie attraverso un'applicazione giudiziosa di ossido di rutenio catalitico (RuO 2 ) nanoparticelle.
Le batterie Li–O2 eliminano i catodi di ossido di metallo pesante utilizzati nelle batterie convenzionali agli ioni di litio per consentire al litio di reagire direttamente con l'ossigeno atmosferico su catodi fatti di luce, materiali porosi come i nanotubi di carbonio. Quando la batteria si scarica, ioni di litio e ossigeno gassoso reagiscono per formare perossido di litio (Li 2 oh 2 ) cristalli sul catodo. Per ricaricare la batteria, l'isolante Li 2 oh 2 i cristalli devono essere decomposti, una reazione che richiede significativi potenziali di ricarica, che può ridurre la durata della batteria.
Byon e Yilmaz hanno cercato di migliorare l'efficienza di ricarica della batteria aggiungendo RuO 2 nanoparticelle ai catodi di nanotubi di carbonio. "RuO 2 ha un'energia superficiale ottimale per l'assorbimento dell'ossigeno ed è un buon catalizzatore per le reazioni di ossidazione, " spiega Yilmaz. Tuttavia, poiché la maggior parte delle catalizzazioni a base di rutenio vengono eseguite in soluzioni acquose, la squadra ha dovuto procedere con cautela per capire cosa sarebbe successo quando RuO 2 era circondato da solido Li 2 oh 2 .
Gli esperimenti hanno rivelato che il nuovo composito di nanotubi RuO2/carbonio ha notevolmente ridotto il potenziale di ricarica della batteria rispetto ai catodi realizzati con i soli nanotubi. Per capire perché, i ricercatori hanno collaborato con il Synchrotron Radiation Center presso l'Università Ritsumeikan di Kyoto per caratterizzare i prodotti di scarica utilizzando una serie di tecniche, compresa la spettroscopia di assorbimento dei raggi X e la microscopia elettronica. Questi test hanno rivelato che il Li 2 oh 2 depositi sul RuO 2 i nanotubi caricati avevano una morfologia amorfa abbastanza diversa da quella osservata in qualsiasi altro Li-O 2 sistema di batterie.
Le immagini al microscopio elettronico hanno mostrato che Li 2 oh 2 particelle che si sono formate sui catodi di nanotubi nudi avevano grandi, cristalli a forma di aureola. Sul RuO 2 /catodi di nanotubi di carbonio, però, uno strato informe di Li 2 oh 2 rivestito l'intero nanotubo (Fig. 1). Il team osserva che questo strato di Li2O2 ha un'ampia area di contatto con il catodo conduttore di nanotubi di carbonio. Di conseguenza, Li 2 oh 2 la decomposizione può essere ottenuta con meno energia, con conseguente miglioramento dell'efficienza della batteria.
"Questo è uno dei primi studi che mostra come i catalizzatori influenzino il Li-O . non acquoso 2 batterie; fino ad ora c'è stata poca attenzione sull'impatto della struttura Li2O2 sulle prestazioni della batteria, " dice Byon. "Questa ricerca potrebbe fungere da linea guida per futuri approcci alternativi".