
Molti batteri e archaea si racchiudono all'interno di un guscio protettivo autoassemblante di proteine dello strato S, come un'armatura di maglia. Il processo è un modello per l'autoassemblaggio di nanostrutture organiche e inorganiche 2D e 3D.
Immagina migliaia di copie di una singola proteina che si organizzano in una corazza di cotta di maglia che protegge chi la indossa da condizioni ambientali dure e in continua evoluzione. Questo è il caso di molti microrganismi. In un nuovo studio, i ricercatori del Lawrence Berkeley National Laboratory (Berkeley Lab) del Dipartimento dell'Energia degli Stati Uniti hanno scoperto dettagli chiave in questo processo naturale che può essere utilizzato per l'autoassemblaggio di nanomateriali in complesse strutture bi e tridimensionali.
Caroline Ajo-Franklin, un chimico e biologo sintetico presso la Molecular Foundry del Berkeley Lab, ha condotto questo studio in cui sono state utilizzate misurazioni di diffusione della luce ad alto rendimento per studiare l'autoassemblaggio di nanofogli 2D da una comune proteina dello strato superficiale batterico (strato S). Questa proteina, denominato "SbpA, " forma l'armatura protettiva per Lysinibacillus sphaericus, un batterio del suolo usato come tossina per controllare le zanzare. La loro indagine ha rivelato che gli ioni di calcio svolgono un ruolo chiave nel modo in cui questa armatura si assembla. Due ruoli chiave in realtà.
"Gli ioni di calcio non solo innescano il ripiegamento della proteina nella forma corretta per la formazione di nanofogli, ma servono anche per legare insieme i nanofogli, "Ajo-Franklin afferma. "Stabilendo e utilizzando la diffusione della luce come proxy per la formazione di nanoschemi SbpA, siamo stati in grado di determinare come la variazione delle concentrazioni di ioni calcio e SbpA influenzi la dimensione e la forma dell'armatura dello strato S".
I dettagli su questo studio sono stati pubblicati sulla rivista ACS Nano in un articolo intitolato "Controllo ione-specifico della dinamica di autoassemblaggio di un reticolo proteico nanostrutturato". Ajo-Franklin è l'autore corrispondente. I coautori sono Behzad Rad, Thomas Haxton, Alberto Shon, Seong-Ho Shin e Stephen Whitelam.
Nel mondo microbico dei batteri e degli archei, le minacce esterne abbondano. L'ambiente circostante può passare dal caldo estremo al freddo estremo, o da altamente acido a altamente basico. I predatori sono ovunque. Per proteggersi, molti batteri e archaea si racchiudono all'interno di un guscio di proteine dello strato S. Sebbene gli scienziati siano a conoscenza di questo rivestimento protettivo da molti anni, come si forma è stato un mistero.
Ajo-Franklin ei suoi colleghi hanno esplorato le proteine autoassemblanti come un potenziale mezzo per creare nanostrutture con struttura e funzione complesse.
"Alla Fonderia Molecolare, siamo diventati davvero bravi a creare nanomateriali in forme diverse, ma stiamo ancora imparando come assemblare questi materiali in strutture organizzate, "Le proteine dello strato S sono abbondanti proteine biologiche note per auto-assemblarsi in nanofogli cristallini 2D con simmetrie reticolari e dimensioni dei pori che sono circa le stesse dimensioni dei punti quantici e dei nanotubi. Questo li rende un sistema modello convincente per la creazione di array nanostrutturati di materiali organici e inorganici in modo dal basso verso l'alto".
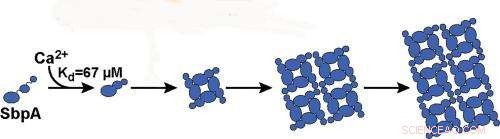
Il legame degli ioni calcio alle proteine SbpA avvia il processo mediante il quale l'SbpA si autoassembla in nanofogli. Ca2+ si lega a SbpA con un'affinità di 67 μM. Credito:immagine per gentile concessione del gruppo Ajo-Franklin, Berkeley Lab
In questo ultimo studio, misurazioni della diffusione della luce sono state utilizzate per tracciare diagrammi che hanno rivelato la resa relativa di nanofogli autoassemblati su un'ampia gamma di concentrazioni di SbpA e ioni calcio. Inoltre, sono stati esaminati gli effetti della sostituzione degli ioni di manganese o bario per gli ioni di calcio per distinguere tra un ruolo di catione bivalente chimicamente specifico e generico per gli ioni di calcio. Behzad Rad, l'autore principale di ACS Nano carta, e i colleghi hanno seguito la diffusione della luce attraverso la luce nello spettro visibile. Hanno quindi correlato il segnale alla formazione di nanofogli utilizzando la microscopia elettronica e la diffusione di raggi X ad angolo ridotto (SAXS), una tecnologia in grado di fornire informazioni sugli assemblaggi molecolari praticamente in qualsiasi tipo di soluzione. Le misurazioni SAXS sono state ottenute presso la "SIBYLS beamline (12.3.1) della Advanced Light Source del Berkeley Lab.
"Abbiamo appreso che solo gli ioni calcio attivano il processo di autoassemblaggio di SbpA e che le concentrazioni di ioni calcio all'interno della cellula sono troppo basse per la formazione di nanofogli, che è una buona cosa per il batterio, " dice Rad. "Abbiamo anche scoperto che l'evoluzione temporale delle tracce di diffusione della luce è coerente con la crescita irreversibile di fogli da un nucleo trascurabile. Non appena cinque ioni calcio si legano a una proteina SbpA, il processo inizia e il cristallo cresce molto velocemente. Il piccolo nucleo è ciò che fa funzionare la nostra tecnica di diffusione della luce."
Ajo-Franklin, Rad e i loro coautori ritengono che la loro tecnica di diffusione della luce sia applicabile a qualsiasi tipo di proteina che si autoassembla in nanofogli 2D, e può essere utilizzato per monitorare la crescita dalla scala nanometrica a quella micrometrica.
Data la natura robusta delle proteine dello strato S e la loro qualità adesiva - i batteri usano la loro armatura dello strato S per attaccarsi all'ambiente circostante - ci sono molte applicazioni interessanti che attendono ulteriori studi.
"Un progetto che stiamo esplorando sta utilizzando le proteine SbpA per creare nanostrutture adesive che potrebbero essere utilizzate per rimuovere metalli e altri contaminanti dall'acqua, " Dice Ajo-Franklin. "Ora che abbiamo una buona conoscenza di come le proteine SbpA si autoassemblano, vorremmo iniziare a mescolarli e abbinarli con altre molecole per creare strutture nuove e utili".