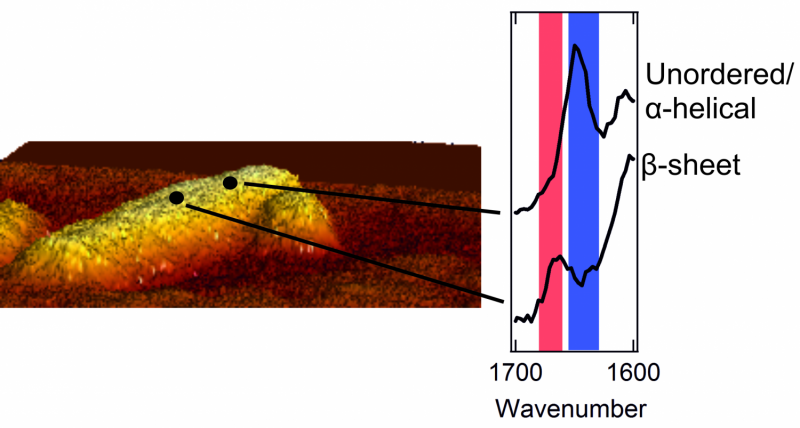
A sinistra:immagine al microscopio a forza atomica di una fibrilla del diametro di pochi nanometri. A destra:due spettri che mostrano la struttura esterna. Un picco nell'area rossa è caratteristico di una patch con una struttura di fogli beta ordinata. Un picco nell'area blu è tipico di un'area con un caotico, struttura disordinata.
I ricercatori dell'Istituto FOM AMOLF hanno, per la prima volta in assoluto, è riuscito a fare un'immagine della struttura esterna di un aggregato proteico che causa malattie come l'Alzheimer e il diabete di tipo 2. Hanno scoperto che la superficie esterna di questi aggregati è strutturata in modo molto disordinato, molto diverso dai loro interni ordinatamente disposti. I ricercatori sperano che il loro lavoro fornisca maggiori informazioni sul modo in cui gli aggregati danneggiano le cellule vicine. I risultati della ricerca sono stati pubblicati online sulla rivista Piccolo il 7 maggio, 2015.
Gli aggregati proteici studiati dai ricercatori sono costituiti da lunghi, proteine ripiegate. I ricercatori hanno familiarità con la struttura interna di questi aggregati (formalmente noti come fibrille amiloidi) da molto tempo. Però, con i microscopi convenzionali è sempre rimasto impossibile vedere le strutture proteiche sulla superficie esterna degli aggregati. Ripensandoci, era come se i ricercatori fossero chiusi dentro una casa. Potevano studiare a fondo l'interno della casa, ma finché non avevano la chiave, non potevano uscire e guardare la sua facciata dall'esterno. La svolta è arrivata quando i ricercatori hanno ideato quella "chiave" combinando due diverse tecniche:microscopia e spettroscopia. Questo ha permesso loro di studiare finalmente la "muratura" esterna.
Disordinato
Una volta che potevano intravedere l'esterno degli aggregati proteici, i ricercatori hanno avuto una sorpresa. L'interno degli aggregati è rigorosamente organizzato. Le proteine sono disposte ordinatamente in una cosiddetta struttura a fogli beta, che forma un contorto, foglio pieghettato. Però, hanno scoperto che l'esterno dell'aggregato ha una struttura molto più caotica e disordinata. Questo è, le proteine esterne formano una struttura disorganizzata, modello irregolare. Qui e li, ci sono patch che formano una struttura di fogli beta, ma in altri luoghi questa regolarità non si trova da nessuna parte. I ricercatori hanno persino trovato differenze strutturali da un nanometro all'altro, su una stessa fibrilla.
I ricercatori hanno anche notato che la struttura esterna di ogni fibrilla è molto diversa dall'altra. Una fibrilla può contenere molti cerotti con una struttura a foglio beta, mentre un altro manca quasi completamente di queste patch regolari. Inoltre, anche gli amminoacidi che si trovano all'esterno differiscono per ogni fibrilla.
L'esterno disordinato è a diretto contatto con le membrane delle cellule vicine. In questo modo, la sua struttura svolge un ruolo cruciale nel danneggiare queste cellule. Questo tipo di danno cellulare si trova comunemente nei pazienti con diabete di tipo 2 o malattia di Alzheimer.
La "chiave" che ha aperto le porte
I ricercatori AMOLF hanno collaborato con i loro colleghi dell'Università di Utrecht, l'Istituto Max Planck per la ricerca sui polimeri di Magonza, e l'Istituto Leibniz per la tecnologia fotonica di Jena per sviluppare un nuovo modo di visualizzare la struttura proteica esterna degli aggregati. La chiave si è rivelata una combinazione di spettroscopia e microscopia a forza atomica.
Un microscopio a forza atomica è costituito da una punta acuminata (sonda) che si muove sulla superficie di un oggetto. Ciò consente al microscopio di esplorare una fibrilla amiloide su scala atomica e creare una mappa in rilievo. Nel frattempo, lo spettrometro misura il cosiddetto spettro Raman per ogni pixel della mappa. Questi spettri forniscono informazioni sul modo in cui le proteine sono ripiegate, e la presenza di amminoacidi specifici sulla superficie degli aggregati. I segnali misurati dallo spettrometro sono generalmente deboli, ma uno strato metallico sulla punta del microscopio le amplifica grandemente.
Le immagini dell'esterno delle fibrille amiloidi erano state fatte in precedenza, ma il team ora ha anche immaginato il modo in cui le proteine erano piegate. Primo autore Corianne van den Akker:"Combinando microscopia e spettroscopia, siamo riusciti a collegare ogni parte della struttura a una posizione sull'esterno dell'amiloide. In questo modo, potremmo fare una foto con risoluzione su scala nanometrica, così come determinare la struttura in ogni luogo. Questa è l'impresa unica della tecnica che abbiamo usato."
Il prossimo passo
Con le nuove conoscenze acquisite, sarà possibile misurare anche la struttura delle amiloidi che si sono formate all'esterno delle cellule viventi. La tecnica può essere utilizzata anche per testare farmaci che mirano a prevenire o dissolvere gli aggregati proteici.