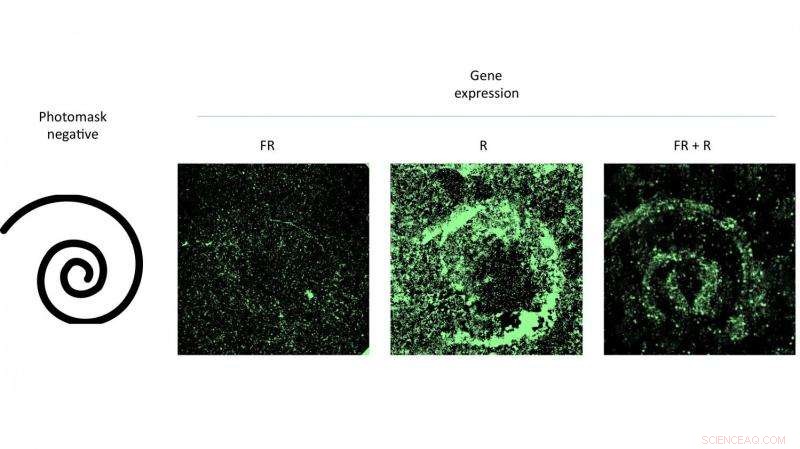
Colpire una capsula di Petri di cellule che conteneva un virus modificato con luce rossa modellata ha incoraggiato l'espressione genica che corrispondeva al modello. L'esperimento degli scienziati della Rice University ha dimostrato l'efficacia di un nuovo sistema di trasmissione genica che può essere controllato con la luce. Credito:Eric Gomez/Rice University
La luce sta aiutando gli scienziati della Rice University a controllare sia l'infettività dei virus che la consegna genica ai nuclei delle cellule bersaglio.
I ricercatori hanno sviluppato un metodo per utilizzare due tonalità di rosso per controllare il livello e la distribuzione spaziale dell'espressione genica nelle cellule tramite un virus ingegnerizzato.
Sebbene i virus si siano evoluti per fornire geni nelle cellule ospiti, hanno ancora difficoltà a portare i loro carichi utili dal citoplasma nel nucleo di una cellula, dove avviene l'espressione genica. I laboratori Rice dei bioingegneri Junghae Suh e Jeffrey Tabor hanno trovato con successo un modo per superare questo ostacolo critico.
La ricerca del team appare questa settimana sulla rivista dell'American Chemical Society ACS Nano .
Il risultato dei laboratori della BioScience Research Collaborative di Rice combina l'interesse di Suh nella progettazione di virus per fornire geni alle cellule bersaglio con le competenze di Tabor in optogenetica, in cui le proteine sensibili alla luce possono essere utilizzate per controllare il comportamento biologico.
Hanno costruito vettori di virus adeno-associati (AAV) personalizzati incorporando proteine che si uniscono naturalmente quando esposte alla luce rossa (lunghezze d'onda di 650 nanometri) e si rompono quando esposte al rosso lontano (lunghezze d'onda di 750 nanometri). Queste proteine naturalmente sensibili alla luce aiutano i capsidi virali, i gusci duri che contengono carichi genetici, a entrare nei nuclei delle cellule ospiti.
L'AAV è stato il vettore preferito per l'editing genetico tramite CRISPR/Cas9, una tecnica che promette di curare alcune malattie genetiche, ma i nuclei cellulari presentano un problema, Suh ha detto.

Eric Gomez, studente laureato alla Rice University, tiene in mano una maschera a spirale che ha usato per controllare i modelli di espressione genica in una capsula di Petri. Le cellule nel piatto contenevano un virus modificato che rispondeva alla luce rossa e trasmetteva i propri carichi genetici ai nuclei delle cellule. Credito:Jeff Fitlow/Rice University
"I virus in generale sono relativamente efficienti nel fornire geni nelle cellule, ma sperimentano ancora grandi barriere limitanti, " ha detto. "Se aggiungi questi virus alle cellule, la maggior parte di loro sembra uscire dal nucleo, e solo una piccola frazione si fa strada all'interno, che è l'obiettivo".
Ha detto che il team ha attinto all'esperienza del laboratorio Tabor in optogenetica per aumentare l'efficienza degli AAV. "Jeff lavora con molti diversi tipi di proteine sensibili alla luce. La particolare coppia che abbiamo deciso è stata identificata per la prima volta nelle piante.
"La luce è davvero bella perché puoi applicarla esternamente e puoi controllare molti aspetti:in quali aree viene esposta la luce, la durata dell'esposizione, l'intensità della luce e, Certo, la sua lunghezza d'onda, " lei disse.
La coppia proteica comprende il fitocromo B e il suo partner di legame che interagisce con il fitocromo fattore 6 (PIF6), entrambi trovati in thale crescione. I ricercatori hanno generato cellule ospiti che esprimono il fitocromo B etichettato con una sequenza di localizzazione nucleare, un piccolo peptide noto per aiutare a trasportare le proteine nel nucleo in modo più efficace. Il PIF6 più piccolo è stato quindi attaccato alla superficie esterna del capside virale.
"Quando i virus vengono interiorizzati in una cellula ospite, si accumulano naturalmente intorno al nucleo, " Suh ha detto. "In condizioni non attivate, la maggior parte dei virus sono bloccati lì. Ma quando brilliamo attivando la luce rossa sulle cellule, queste due proteine vegetali dimerizzano - si uniscono - e a causa del tag di localizzazione nucleare sul fitocromo B, il virus viene trascinato nel nucleo."
Questa è la prima volta che le proteine optogenetiche vengono utilizzate per controllare l'infettività dei virus, lei disse, aggiungendo, "Non pensavamo che avrebbe funzionato così bene come ha fatto."

Junghae Suh, bioingegnere della Rice University, sinistra, e lo studente laureato Eric Gomez ha condotto uno studio in cui le proteine che rispondono alla luce hanno aiutato i capsidi virali a fornire il loro contenuto ai nuclei delle cellule. I ricercatori vedono la loro tecnica come un modo per controllare l'espressione genica. Credito:Jeff Fitlow/Rice University
L'autore principale Eric Gomez, uno studente laureato nel laboratorio di Suh, e co-autore Karl Gerhardt, uno studente laureato nel laboratorio di Tabor, hanno dimostrato la tecnica attivando modelli di cellule infette da AAV in piastre di Petri illuminandole con luce rossa attraverso maschere.
Suh ha affermato che la piattaforma potrebbe essere utilizzata in futuro per controllare quali cellule e tessuti esprimono un gene ea quale livello. La strategia potrebbe trovare impiego anche in applicazioni di ingegneria tissutale come i bioscaffold per l'impianto. "Qui, potresti voler convincere le cellule staminali a svilupparsi nelle cellule giuste in una sorta di modo spazialmente coordinato, " lei disse.
L'uso nel corpo è più lontano, perché la luce rossa applicata esternamente attraversa solo il tessuto per raggiungere i bersagli. "In definitiva, dipenderà dal dispositivo che usi per fornire la luce, " ha detto. "Ma immaginiamo casi in cui potresti usare un catetere per andare nel punto in cui vuoi che i virus siano molto più infettivi".
Suh ha affermato che i laboratori Rice stanno lavorando per rendere la prossima generazione di capsidi sia più efficace che più realizzabile. "Questo è solo il primo passo, " ha detto. "Abbiamo un sacco di domande, come 'Possiamo davvero farlo in vivo?' tipo di domande.
"Ci sono stati una manciata di documenti che hanno cercato di rendere il processo infettivo del virus reattivo alla luce, ma erano prima dell'era dell'optogenetica, "Suh ha detto. "Stavano usando altri tipi di molecole sintetiche per rendere i virus sensibili alla luce.
"Sembra che l'utilizzo di ciò che Madre Natura ha già fornito sotto forma di proteine sensibili alla luce funzioni davvero bene per noi".