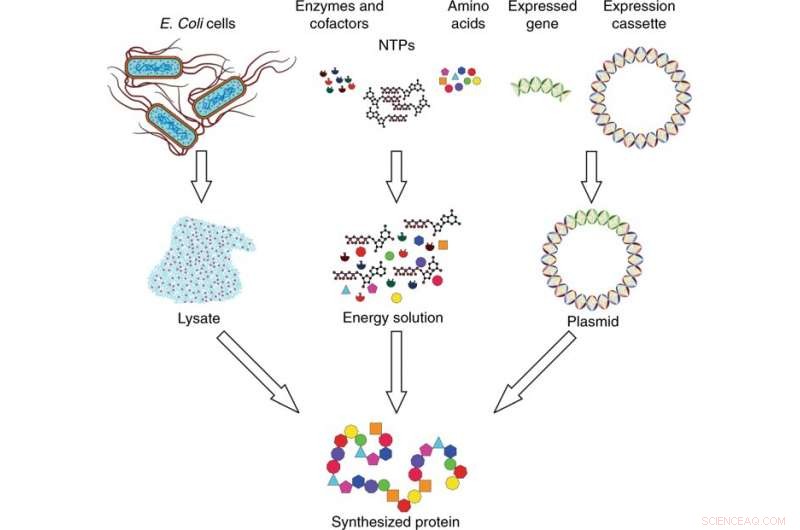
Panoramica del sistema di sintesi proteica senza cellule. Il sistema di sintesi è costituito da tre componenti:lisato, soluzione energetica, e DNA plasmidico. Il lisato viene raccolto dalle cellule di E. coli mediante lisi cellulare e preparato mediante ultracentrifugazione. La soluzione energetica è composta da nucleosidi trifosfati (NTP), aminoacidi, enzimi, e cofattori. Il DNA plasmidico viene prodotto inserendo il gene di interesse espresso in una cassetta di espressione. I tre componenti vengono combinati e incubati per sintetizzare la proteina di interesse. Credito:Microsistemi e nanoingegneria, doi:10.1038/s41378-019-0051-8
Le proteine terapeutiche sono farmaci candidati a base di proteine bioingegnerizzati in laboratorio per applicazioni farmaceutiche e cliniche. Sulla base della loro farmacocinetica, i candidati possono essere suddivisi in gruppi che (1) sostituiscono una proteina difettosa o anormale, (2) aumentare un percorso esistente in vivo, (3) fornire una nuova funzione o attività in vivo, (4) interferisce con le attività di una molecola o di un organismo e (5) fornisce proteine o composti incapsulati tra cui, farmaci citotossici, radionuclidi o proteine effettrici.
In un recente studio pubblicato su Microsistemi e nanoingegneria , Travis W. Murphy e i colleghi dei dipartimenti di ingegneria dei sistemi chimici e biologici della Virginia Tech hanno sviluppato una soluzione economicamente vantaggiosa, piattaforma di sintesi e purificazione point-of-care per l'ingegneria delle proteine. Hanno costruito un dispositivo microfluidico integrato "Therapeutics-on-a-Chip (TOC)" per cellulari, sintesi proteica terapeutica e purificazione proteica terapeutica in un unico setup.
La capacità di sintetizzare proteine terapeutiche in un ambiente point-of-care, può ridurre rapidamente i costi di stoccaggio e trasporto durante la distribuzione globale nelle regioni povere di risorse e contribuire al concetto di scienza frugale. La maggior parte delle proteine viene attualmente prodotta utilizzando sistemi di coltura cellulare come l'Escherichia coli ricombinante, lievito, cellule di mammifero e cellule vegetali per la produzione su larga scala, dopodiché vengono distribuiti globalmente da fonderie centralizzate. Però, l'emivita limitata di queste proteine sintetiche richiede strutture di stoccaggio e spedizione a bassa temperatura che sono difficili per i pazienti che vivono in regioni remote e con poche risorse.
Nel presente lavoro, Murphy et al. ha prima dimostrato i principi di funzionamento del dispositivo esprimendo e purificando una proteina reporter - proteina fluorescente verde. Seguito dall'uso di TOC per produrre cecropin B, un peptide antimicrobico ampiamente utilizzato per controllare le malattie del biofilm. Gli scienziati hanno sintetizzato e purificato con successo la cecropina B per produrre una concentrazione di 63 ng/µL in sei ore, con una purezza del 92 percento, seguita dalla conferma delle sue proprietà antimicrobiche con un test di inibizione della crescita. La tecnologia TOC fornisce una nuova piattaforma per la sintesi proteica point-of-care e la purificazione per terapie cliniche accessibili.
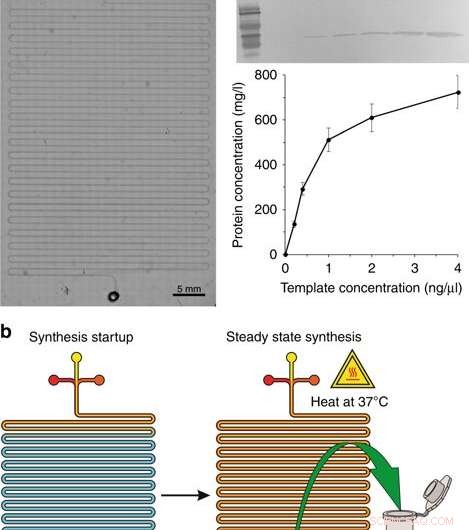
a) Un'immagine microscopica del modulo di sintesi. b) Le fasi della sintesi:inizio della sintesi e sintesi allo stato stazionario. c Western blotting della GFP prodotta nel sistema CFPS e resa proteica con diverse concentrazioni dello stampo plasmidico. L'anticorpo primario monoclonale di topo 6 × His e l'anticorpo secondario di capra anti-IgG di topo coniugato con HRP (H + L) sono stati utilizzati per rilevare la proteina bersaglio. Le concentrazioni elencate sono le concentrazioni nel volume di reazione finale. Credito:Microsistemi e nanoingegneria, doi:10.1038/s41378-019-0051-8
I dispositivi all'avanguardia attualmente in uso per la sintesi proteica al punto d'uso includono un sistema delle dimensioni di un frigorifero che copre un ciclo di produzione-purificazione di due giorni per produrre 800 dosi di un farmaco al giorno. Eppure il costo del capitale associato a un tale sistema non è fattibile nei paesi in via di sviluppo, dove la necessità di una rapida produzione di terapie di massa per la distribuzione supera la produzione di terapie di massa per la conservazione a lungo termine. Nel sistema TOC sviluppato da Murphy et al. gli scienziati hanno realizzato la sintesi point-of-care e la purificazione delle proteine terapeutiche utilizzando un processo di sintesi proteica senza cellule (CFPS). In questo sistema, le proteine ricombinanti sono state espresse senza l'uso di cellule viventi, adatto per la produzione point-of-care, dove i materiali di partenza liofilizzati potrebbero rimanere stabili durante lo stoccaggio in un ampio intervallo di temperature.
Tra le proteine esaminate nello studio, cecropina B ha una concentrazione inibitoria minima di 9,5 ng/µl per esercitare effetti antimicrobici. Utilizzando la configurazione microfluidica, gli scienziati hanno combinato la sintesi proteica e la purificazione per produrre un peptide antimicrobico cecropina B a una dose clinicamente rilevante (63 ng/µl). La produzione a flusso continuo nell'impianto è stata completata in tre fasi di sviluppo:
Murphy et al. utilizzato stampaggio a base di polidimetilsilossano (PMDS) a litografia morbida per fabbricare i dispositivi; costruzione di multistrati mediante valvole micromeccaniche.
Durante la prima fase di progettazione del dispositivo nel reattore CFPS, gli scienziati hanno fabbricato un chip microfluidico a canale serpentino, simile a studi precedenti per la sintesi proteica su chip. Il dispositivo microfluidico conteneva ingressi collegati a una pompa a siringa posta sul tavolino riscaldante di un microscopio, dove tre ingressi hanno ricevuto (1) lisato cellulare, (2) tampone di reazione CFPS e (3) stampo di DNA nel lungo canale a serpentina (circa 130 cm) con un'uscita. Gli scienziati hanno alimentato i tre componenti della reazione a una portata combinata di 0,15 µl/min azionata da una pompa a siringa per un tempo di permanenza di 1,5 ore. Hanno riscaldato il reattore con un riscaldatore a stadi (37 gradi C) e hanno modellato la configurazione utilizzando il software COMSOL Multiphysics per verificare la meccanica del dispositivo, per una miscelazione e una reazione ottimali basate sulla diffusione su chip. Per convalidare i principi di funzionamento del dispositivo, Murphy et al. sintetizzato la proteina reporter, GFP utilizzando una varietà di modelli di DNA. Il sistema ha prodotto volumi di proteine a un tempo di reazione costante.
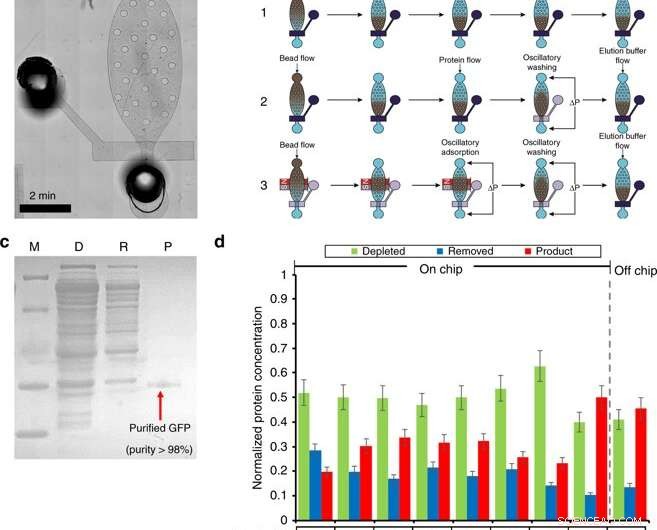
Purificazione delle proteine in camera microfluidica. a) Un'immagine microscopica del modulo di purificazione. b) Panoramica della procedura di purificazione (compreso il caricamento delle sferette, formazione del letto, assorbimento di proteine, lavaggio, ed eluizione) da tre diversi flussi di lavoro. Il flusso di lavoro 1 utilizza l'adsorbimento del flusso e le fasi di lavaggio. Il flusso di lavoro 2 utilizza l'adsorbimento del flusso e il lavaggio oscillatorio. Il flusso di lavoro 3 utilizza l'adsorbimento oscillatorio e il lavaggio. Il blu scuro denota una valvola chiusa, dove la trasparenza denota una valvola aperta. c) SDS-PAGE di GFP purificata dal chip di purificazione. M (marcatore); D (Esaurita):Miscela di reazione CFPS dopo l'assorbimento delle sferette; R (Rimosso):contaminanti rimossi nel tampone di purificazione; P (Prodotto):GFP purificata nel tampone di eluizione. d) L'ottimizzazione della fase di purificazione. L'ottimizzazione è stata condotta esaminando 4 condizioni. (1) volume di sfere Ni-NTA di 5 o 8 µl; (2) 0,5% di Tween-20 aggiunto ai tamponi di purificazione ed eluizione. (3) Diversi flussi di lavoro. (4) Diversi tempi di assorbimento oscillatorio. Credito:Microsistemi e nanoingegneria, doi:10.1038/s41378-019-0051-8
Nella seconda fase, Murphy et al. progettato un dispositivo microfluidico per la purificazione delle proteine basato su un protocollo di adsorbimento e lavaggio ad alta efficienza, come dimostrato in precedenza dallo stesso gruppo di ricerca. Hanno azionato il dispositivo utilizzando elettrovalvole per controllare la singola valvola micromeccanica e gli impulsi di pressione oscillatoria associati per eseguire la purificazione delle proteine in quattro fasi principali.
Nel flusso di lavoro, i passaggi erano (1) caricamento del tallone, (2) adsorbimento di proteine, (3) lavaggio e (4) eluizione. Per ottimizzare il processo, gli scienziati hanno suddiviso il metodo in tre diversi flussi di lavoro. Murphy et al. poi ha variato le condizioni che influenzano i risultati della purificazione delle proteine per ottenere una purezza del prodotto fino al 98,5%, con una resa del 54,6 per cento del prodotto, superando altri metodi.
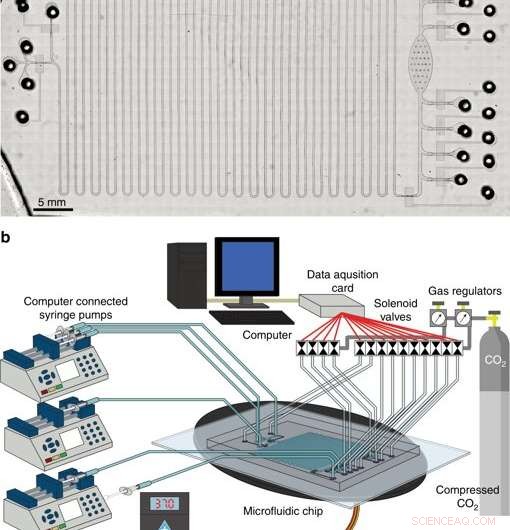
Il sistema integrato per la sintesi e la purificazione di proteine prive di cellule. a Micrografia della piattaforma CFPS + P integrata. b Panoramica della configurazione della piattaforma CFPS + P integrata. Il sistema è costituito da elettrovalvole controllate da computer e pompe a siringa collegate a un dispositivo microfluidico posto su una fase di riscaldamento. Credito:Microsistemi e nanoingegneria, doi:10.1038/s41378-019-0051-8.
Nella fase tre, gli scienziati hanno sviluppato una piattaforma microfluidica integrata con sintesi e purificazione di proteine prive di cellule (CFPS+P) per l'automazione. Hanno combinato un reattore a flusso continuo e un dispositivo di purificazione batch, sebbene i due processi non fossero intrinsecamente compatibili l'uno con l'altro all'inizio. Per ottenere una compatibilità adeguata, hanno interfacciato i due processi utilizzando un serbatoio a tubo che ha immagazzinato la proteina prodotta continuamente su un chip, prima della purificazione. Tutti gli apparati utilizzati nello studio per far funzionare il sistema microfluidico potrebbero potenzialmente adattarsi alle dimensioni di una valigetta, rendendolo altamente portatile, sistema terapeutico di produzione di proteine.
In totale, il chip CFPS+P completamente integrato conteneva cinque passaggi principali tra cui, adescamento, sintesi proteica, assorbimento di proteine, lavaggio ed eluizione. In un sesto passo, gli scienziati hanno organizzato il rinfresco delle perle. Murphy et al. utilizzato il canale di sintesi a serpentina come modulo di sintesi individuale, dopo aver sintetizzato la quantità desiderata di proteine, spengono la configurazione dal modulo di purificazione per avviare il successivo processo di purificazione. Per testare il flusso di lavoro della configurazione, gli scienziati hanno utilizzato GFP e hanno raggiunto una purezza del 98 percento.
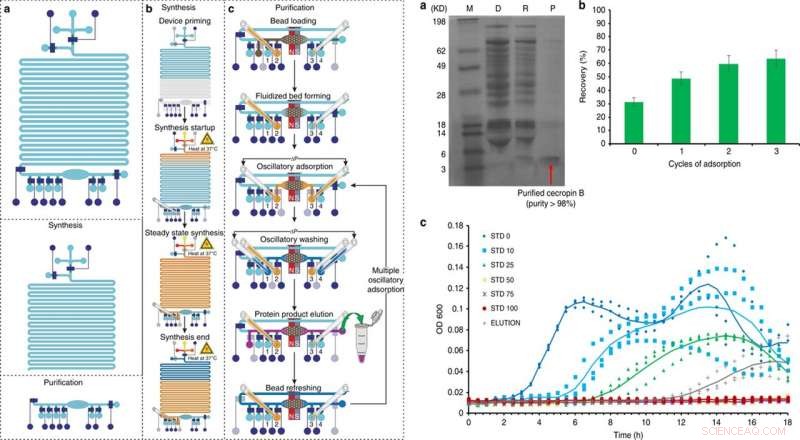
A SINISTRA:Panoramica e funzionamento della sintesi proteica priva di cellule integrata e della piattaforma di purificazione in 5 fasi principali:a) priming, b) sintesi proteica, c) assorbimento di proteine, lavaggio, ed eluizione, con un sesto passaggio opzionale di rinfresco del cordone. Credito:Microsistemi e nanoingegneria, doi:10.1038/s41378-019-0051-8. A DESTRA:Sintesi e purificazione di Cecropin B mediante dispositivo microfluidico CFPS + P integrato. a) Tricine-PAGE della cecropina B sintetizzata e purificata dal chip integrato. M (marcatore); D (esaurito):miscela di reazione CFPS dopo l'assorbimento delle perle; R (rimosso):contaminanti rimossi nel tampone di purificazione; P (prodotto):AMP purificato nel tampone di eluizione. b) Ottimizzazione del recupero della cecropina B utilizzando più cicli di adsorbimento. c) Saggi di inibizione della crescita di E. coli condotti in triplicato, utilizzando il prodotto proteico (eluizione) dopo tre cicli di adsorbimento/eluizione dal nostro dispositivo rispetto agli standard di cecropina B di diverse concentrazioni (0-100 ng/μl, indicato come STD 0-100). OD600 è stato misurato ogni 30 min per 18 h. È stata utilizzata l'eluizione con una concentrazione di 27 ng/μl in una soluzione di 60 μl. Le linee di tendenza che rappresentano la media di tre prove vengono aggiunte per guidare l'occhio. Credito:Microsistemi e nanoingegneria, doi:10.1038/s41378-019-0051-8.
Dopo l'ottimizzazione del flusso di lavoro CFPS+P utilizzando GFP, gli scienziati hanno utilizzato la stessa configurazione per ottimizzare le condizioni per sintetizzare la cecropina B. Seguendo le fasi di espressione, purificazione, elettroforesi e colorazione nel setup, Murphy et al. ha confermato il successo della produzione e della purificazione della cecropina B e delle proteine solubili recuperate per eluire 63 ng/µL, con una purezza del 92 percento. Hanno quindi testato la bioattività della cecropina B rispetto a E. coli inibizione per dimostrare un'attività antibiotica efficace inibendo la crescita batterica.
In questo modo, le proteine terapeutiche sintetizzate e purificate utilizzando la configurazione microfluidica hanno dimostrato una soppressione attiva ed efficace della crescita batterica. Il sistema conveniente può essere attivamente integrato in ambienti a basse risorse per la scienza frugale. Murphy et al. intendono automatizzare completamente il sistema sulla base di ottimizzazioni continue in futuro. Prevedono applicazioni della configurazione per progettare una gamma di diverse proteine terapeutiche per una produzione point-of-care conveniente.
© 2019 Scienza X Rete