
Schemi di riconfigurazione delle pareti fluide. Guarda il film completo su, Credito:progressi scientifici, doi:10.1126/sciadv.aav8002
Le piastre per colture cellulari di uso quotidiano in biologia possono essere efficacemente trasformate in dispositivi microfluidici, aprire percorsi ai biologi per miniaturizzare i flussi di lavoro basati sulle cellule. In un recente rapporto, dottorato di ricerca il ricercatore Cristian Soitu e collaboratori nei dipartimenti di Scienze e Patologia dell'Ingegneria dell'Università di Oxford, Oxford, UK., descritto un metodo semplice per creare disposizioni microfluidica intorno alle cellule. Nello studio, le cellule stavano già crescendo su superfici standard di piastre Petri, quando gli scienziati hanno utilizzato l'interfaccia tra i fluidi immiscibili nel contenitore come materiale da costruzione.
Hanno riproposto i tradizionali piatti di coltura cellulare in sofisticati dispositivi microfluidici su richiesta rimodellando le strutture fluide attorno alle cellule viventi. Soitu descrive la nuova tecnica di modellazione del fluido costruita dal suo team di ricerca come "strutture fluide per quelle cellule che temono di impegnarsi nella scelta di una casa:possono essere facilmente rimosse e ne possono essere costruite di nuove (con una geometria diversa)". La ricerca è ora pubblicata su Progressi scientifici
I ricercatori hanno dimostrato il metodo utilizzando flussi di lavoro che comportano la clonazione cellulare; clonazione selettiva di un clone specifico tra gli altri in un piatto; trattamenti farmacologici; e la guarigione delle ferite. Il lavoro di ricerca ha dimostrato un approccio versatile, accoppiato a caratteristiche biologicamente compatibili per promuovere la tecnologia della microfluidica tra i biologi. Gli approcci basati sulla microfluidica hanno guadagnato popolarità in molti flussi di lavoro, sebbene il loro assorbimento nella biologia tradizionale rimanga lento a causa di una serie di ragioni che contribuiscono, Compreso:
Nel passato, gli scienziati hanno creato costrutti 3D con pareti fluide su scala nanometrica, anche se la loro biocompatibilità resta da valutare. Nel presente lavoro, perciò, Soit et al. ha sviluppato un metodo per creare matrici di camere microfluidiche isolate su piastre di Petri vergini per adattarsi ai principali flussi di lavoro nella biologia cellulare. Possibili esempi includono l'alimentazione e il trasferimento delle cellule, clonazione, crioconservazione, fissazione e immunomarcatura, lisi cellulare e reazione a catena della polimerasi a trascrizione inversa (RT-PCR) e modifica del gene CRISPR-Cas9. In precedenti esperimenti di tali flussi di lavoro, gli scienziati hanno aggiunto le cellule dopo la fabbricazione della microfluidica.
Nel presente lavoro, i ricercatori hanno creato una varietà di disposizioni microfluidica su piastre di Petri standard contenenti cellule aderenti e le hanno riconfigurate in tempo reale. Hanno isolato e recuperato cloni cellulari per eseguire test antidroga e test di guarigione delle ferite e hanno introdotto la nuova tecnica per creare e riconfigurare circuiti microfluidici su piastre di Petri mentre le cellule crescevano e si dividevano, con molte potenziali applicazioni nella biologia tradizionale.
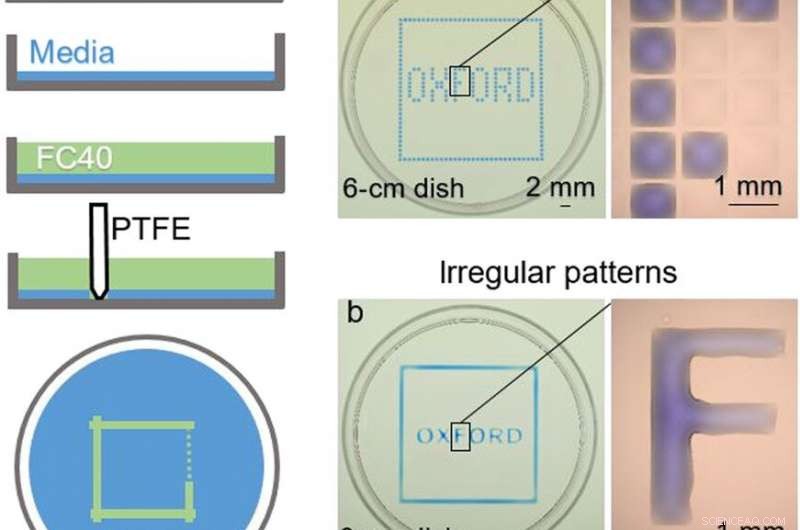
IN ALTO:Costruzione della camera. (A) Principio. Il terreno di Eagle modificato di Dulbecco (DMEM) + 10% di siero fetale bovino (FBS) viene aggiunto a una capsula di Petri vergine, e la maggior parte del mezzo viene rimossa per lasciare un film sottile che copre il fondo, che è sovrapposto a FC40. Lo stilo viene spostato sul fondo per creare una disposizione microfluidica. Una volta completato, il volume iniziale di DMEM + 10% FBS sarà diviso in due parti separate da una parete liquida continua di FC40 fissata al substrato. (B) Diversi modelli. (a) La formazione di linee verticali e orizzontali equidistanti crea una matrice (32 × 32; spaziatura di 1 mm). Prossimo, 60 nl di colorante blu vengono aggiunti dalla stampante alle camere selezionate; le camere periferiche ricevono colorante blu per dare il quadrato blu, e quelli interni danno la parola "OXFORD". L'ingrandimento (a destra) mostra le singole camere senza e con colorante. (b) Un motivo simile viene creato formando due quadrati (uno leggermente più grande dell'altro) con lo stilo e quindi aggiungendo manualmente il colorante nello spazio intermedio; ogni lettera viene realizzata formando i suoi lati e riempiendo nuovamente manualmente l'interno. L'ingrandimento mostra che la lettera "F" è un corpo continuo di liquido. Credito fotografico:Cristian Soitu, Università di Oxford. BOTTOM:Riconfigurazione degli accordi microfluidici. Le immagini mostrano i fotogrammi del film. (1) Viene stampato un motivo iniziale:un cerchio (raggio, 1,5 mm) all'interno di un triangolo (lato, 7 mm) all'interno di un quadrato (lato, 9mm). (da 2 a 4) Diversi coloranti vengono aggiunti a ciascun compartimento (1,5 μl di colorante rosso, 1,5 μl di colorante giallo, e 5 μl di colorante blu); i coloranti sono confinati all'interno delle pareti dell'FC40. (5) Al cerchio viene aggiunto altro colorante giallo. (6) Dopo aver aggiunto 3 μl di colorante giallo, la linea di fissaggio circolare si rompe e il contenuto si riversa nel triangolo. (7) Dopo aver aggiunto 24 μl, la linea di fissaggio triangolare si rompe e il contenuto si riversa nel quadrato. (8) Dal quadrato si prelevano sessanta microlitri. (9) Viene stampato un nuovo motivo:un triangolo (lato, 4,5 mm) in un cerchio (raggio, 3,3 mm)—nel quadrato iniziale. (da 10 a 12) I coloranti colorati vengono aggiunti ai tre diversi scomparti come prima. Credito fotografico:Cristian Soitu, Università di Oxford. Credito:progressi scientifici, doi:10.1126/sciadv.aav8002
La nuova tecnica e gli esperimenti di proof-of-concept
Negli esperimenti che seguirono, i ricercatori hanno prima coperto il fondo di una capsula di Petri con un mezzo di coltura tissutale e hanno rimosso la maggior parte del mezzo per formare una pellicola sottile che ricopre il substrato di polistirene. Hanno ricoperto il film sottile con un fluorocarbonio immiscibile (FC40) per prevenire l'evaporazione e come barriera contro i contaminanti esterni per mantenere la sterilità del mezzo. Quindi utilizzando una punta in teflon, i ricercatori hanno contattato il fondo del piatto, spostando la fase acquosa per formare disposizioni microfluidica sotto forma di interesse, in questo caso, una piazza. Utilizzando la tecnica, i ricercatori hanno portato i vantaggi della piattaforma microfluidica aperta ai prodotti per colture cellulari standard.
Soit et al. modellato la fase acquosa per creare una griglia con bassi volumi di liquido come precedentemente dimostrato dalla stessa squadra, e li ha visti con coloranti selettivi in camere selettive. Ad esempio, le camere periferiche ricevevano un colorante blu (che formava un quadrato blu) e quelle all'interno formavano la parola "OXFORD".

Creazione di camere per l'isolamento di cloni cellulari. Guarda il film completo su, Credito:progressi scientifici, doi:10.1126/sciadv.aav8002
I ricercatori hanno "stampato" un cerchio all'interno di un triangolo all'interno di un quadrato e hanno utilizzato microlitri di tre coloranti per visualizzare separatamente le tre forme; dove FC40 ha impedito la miscelazione dei coloranti. I risultati hanno mostrato la capacità di costruire e distruggere le pareti FC40 per confinare efficacemente i liquidi in qualsiasi forma 2-D desiderata.
Dopo i risultati preliminari del proof-of-concept, Soit et al. matrici generate di camere per ricapitolare la clonazione di cellule tumorali mammarie di topo (NM18), per cui inizialmente hanno creato le griglie, seguito da aggiunta di cellule in seguito. I ricercatori hanno prima permesso alle cellule di crescere liberamente circondate dalla parete FC40 permeabile sia all'O 2 e CO 2 , e poi facendo crescere singole cellule in cloni prima di circondarle con pareti fluide di forme diverse.
Hanno dimostrato che le pareti fluide con diverse impronte 2D potrebbero essere costruite facilmente attorno alle cellule viventi, fintanto che le colonie sono rimaste isolate l'una dall'altra durante il successivo trattamento o recupero. Precedenti studi che hanno coltivato cellule all'interno di confinati, le superfici premodellate richiedevano un trattamento superficiale prima dell'adesione cellulare, contribuendo alla notevole eccezione nella presente tecnica.
Applicazioni nella raccolta di cloni e nei test antidroga
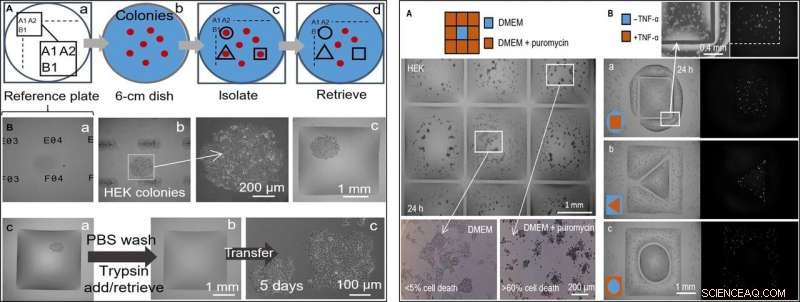
A SINISTRA:raccolta selettiva di cloni semi-automatica (cellule HEK). La stampante aggiunge/rimuove un microlitro alle/dalle camere in diverse fasi. (A) Approccio. (a) Le posizioni su una "piastra di riferimento" di vetro sono contrassegnate da identificatori univoci (cioè, A1, A2 …, B1…). (b) Un piatto di 6 cm con colonie (rosso) è posto sulla piastra di riferimento. (c) Dopo aver registrato le posizioni delle colonie e averle inserite in uno script, le pareti fluide sono stampate attorno ai cloni selezionati (linee nere). (d) I cloni vengono recuperati da queste camere. (B) Isolare un clone. Le cellule HEK sono state piastrate a bassa densità (~ 1 cellula/cm2) e coltivate (8 giorni) in cloni, il piatto è stato posto su un piatto di riferimento, e le pareti sono state costruite attorno a cloni selezionati. Vengono mostrate tre diverse viste dell'asse z di un clone. (a) Targa di riferimento con identificatori univoci in primo piano. (b) Colonia a fuoco (identificatori fuori fuoco) con ingrandimento. (c) Colonia dopo aver costruito le mura di cinta. (C) Selezione di cloni. (a) Muro quadrato costruito intorno a una colonia vivente. La stampante lava le cellule aggiungendo/recuperando 1 μl di PBS; poi aggiunge 1 ml di tripsina. (b) Il piatto viene incubato (37°C; 5 min) per staccare le cellule dalla superficie, e la stampante recupera 1 μl contenente la sospensione ricca di cellule (e la trasferisce in una provetta per microcentrifuga) per lasciare la camera ormai vuota. (c) Le cellule recuperate vengono piastrate manualmente in una micropiastra da 12 pozzetti e coltivate convenzionalmente per 5 giorni; le cellule si attaccano e crescono. A DESTRA:due trattamenti farmacologici affiancati a cellule non trattate. Le pareti fluide sono state costruite attorno alle cellule HEK (300, 000 celle; piatto da 6 cm) coltivato per 24 ore. (A) Puromicina (griglia 3 × 3; camere da 2 mm × 2 mm). La stampante aggiunge 1 µl di terreno alla camera centrale e 1 µl di terreno + puromicina a quelle periferiche (concentrazione finale, 10 mg/ml), come indicato nel fumetto. La vitalità cellulare viene valutata dopo l'incubazione (37°; 24 ore) utilizzando un test di esclusione del tripan blue. Le cellule nelle camere esterne sono morte (più del 60% in ciascuna), mentre quelli in quello centrale rimangono vivi (meno del 5% di morte cellulare). Questo test è stato replicato tre volte. (B) TNF-α. Vengono stampate coppie di camere con forme distinte, uno che circonda l'altro. La stampante aggiunge 0,5 μl di mezzo ± TNF-α (concentrazione finale, 10 ng/ml) all'uno o all'altro volume (come nei cartoni). Poiché le cellule codificano per un gene reporter GFP controllato da un promotore attivato da TNF-α, emettono una fluorescenza verde per esposizione alla citochina. Le immagini a fluorescenza mostrano che solo le cellule nel volume trattato emettono fluorescenza verde. Le coppie di volumi avevano le seguenti dimensioni:(a) quadrato (lato, 1,8 mm) in cerchio (raggio, 1,75mm); (b) triangolo (lato, 1 mm) in quadrato (lato, 3,5mm); (c) cerchio (raggio, 1 mm) in quadrato (lato, 3,5mm). Credito:progressi scientifici, doi:10.1126/sciadv.aav8002
Nel passaggio successivo, i ricercatori hanno creato una piastra di riferimento su cui hanno posizionato un piatto contenente colonie di cellule vive di interesse per isolare i cloni cellulari di interesse dagli altri stampando pareti fluide intorno a loro. In isolamento, potevano scegliere le colonie, recuperare le cellule e farle crescere in modo convenzionale per moltiplicarle come previsto. Poiché le pareti del fluido potrebbero confinare efficacemente i liquidi, Soit et al. hanno testato la loro efficacia aggiungendo puromicina, un inibitore del traduttore di piccole molecole che uccide le cellule di mammifero.
Nella configurazione sperimentale di screening dei farmaci, hanno permesso alla camera centrale di ricevere il solo mezzo di crescita, mentre il farmaco veniva somministrato alle camere circostanti in una dose letale elevata, per mostrare l'efficacia della separazione di FC40 quando sopravvivono solo le linee cellulari nella camera centrale. In un secondo esempio, Soit et al. ha sfruttato la proprietà di una linea cellulare di rene embrionale umano geneticamente modificata per codificare un gene promotore fluorescente verde. Che si accendeva in presenza di fattore di necrosi tumorale-α per diventare verde fluorescente. Le pareti fluide formavano barriere efficaci all'esposizione ai farmaci, verificare il potenziale di screening dei farmaci della tecnica.
Applicazioni nella guarigione delle ferite
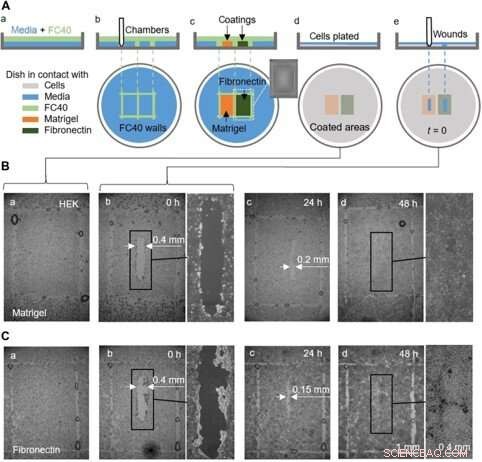
Un test di guarigione delle ferite proof-of-concept utilizzando un piatto prerivestito con Matrigel e fibronectina in diverse regioni. (A) Cartoon che illustra il flusso di lavoro. (a) Uno strato sottile di mezzo è ricoperto con FC40. (b) Due camere (3 mm × 4 mm ciascuna) sono stampate una accanto all'altra. (c) Le superfici nelle camere sono rivestite con Matrigel o fibronectina (2 μl; concentrazione finale di 1 μg/cm2; 1 ora); l'inserto mostra l'immagine di una camera. Le pareti fluide sono ora distrutte, e il piatto viene lavato con 3 mi di mezzo per rimuovere i rivestimenti non attaccati. (d) cellule HEK (600, 000) sono immessi nel piatto. (e) Dopo 24 ore, le cellule hanno formato un monostrato, e viene creata una ferita (0,4 mm × 2 mm) raschiando lo stilo sulla superficie per rimuovere le cellule sul suo percorso. La guarigione della ferita è ora monitorata al microscopio. (B e C) Immagini di ferite in monostrati cresciuti su Matrigel o fibronectina. (a e b) Immediatamente prima e dopo il ferimento (alcune goccioline di FC40 rimangono dove originariamente si trovavano i muri). (c) Dopo 24 ore, la crescita cellulare riduce le larghezze della ferita a <0,2 mm e <0,15 mm con Matrigel e fibronectina, rispettivamente. (d) Entro 48 ore, ferite sono completamente guarite. Credito:progressi scientifici, doi:10.1126/sciadv.aav8002
Hanno anche completato test di guarigione delle ferite con prova di principio utilizzando un unico piatto rivestito in due modi diversi, per monitorare due condizioni di guarigione della ferita. Per questo, i ricercatori hanno utilizzato Matrigel, una proteina gelatinosa secreta dalle cellule del sarcoma e fibronectina, una glicoproteina della matrice extracellulare che ha migliorato la guarigione delle ferite. Hanno aggiunto cellule HEK che hanno formato un monostrato nei piatti e hanno creato una "ferita" trascinando la punta di Teflon attraverso il monostrato quando le cellule migravano nelle ferite a velocità leggermente diverse. Sebbene in questo flusso di lavoro Soitu et al. pre-rivestito la superficie prima di placcare le celle, potrebbero anche modificare la tecnica di rivestimento per la sua aggiunta dopo che le cellule hanno iniziato a migrare nelle ferite appena formate per promuovere la guarigione.
In questo modo, Cristian Soitu e collaboratori hanno sviluppato un flessibile, piattaforma microfluidica per miniaturizzare i flussi di lavoro in biologia cellulare. Hanno esteso la tecnica nel presente lavoro per formare accordi microfluidici attorno a cellule aderenti pre-placcate seguite da una varietà di test di prova del principio sulla clonazione cellulare, screening farmacologico e guarigione delle ferite. La piattaforma presenta molti vantaggi e può sostituire la modalità convenzionale dei dispositivi microfluidici pre-ingegnerizzati come alternativa flessibile e personalizzabile. I nuovi arrangiamenti microfluidici sono convenienti e contribuiscono alla scienza frugale e possono essere riconfigurati in tempo reale durante un esperimento per una maggiore versatilità. I ricercatori notano i limiti della tecnica, comprese le disposizioni ristrette in 2-D e la fragilità delle pareti fluide rispetto alle pareti solide. Soit et al. spero di ottimizzare e combinare queste caratteristiche e vantaggi per fornire una nuova piattaforma per i biologi tradizionali per esplorare il potere della microfluidica.
© 2019 Scienza X Rete