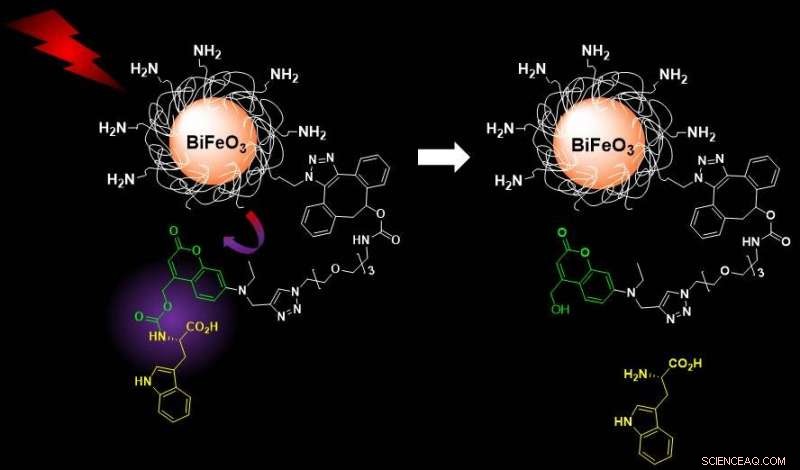
L'eccitazione nel vicino infrarosso di nanoparticelle di ferrite di bismuto funzionalizzate provoca un'emissione armonica che innesca il fotorilascio di carichi molecolari ingabbiati, consentendo applicazioni di imaging disaccoppiato e consegna controllata. Credito:S. Gerber/EPFL
La teranostica è un campo emergente della medicina il cui nome è una combinazione di "terapeutica" e "diagnostica". L'idea alla base della teranostica è di combinare farmaci e/o tecniche per diagnosticare e trattare simultaneamente o in sequenza condizioni mediche, e anche monitorare la risposta del paziente. Ciò consente di risparmiare tempo e denaro, ma può anche aggirare alcuni degli effetti biologici indesiderati che possono sorgere quando queste strategie vengono impiegate separatamente.
Oggi, le applicazioni della teranostica utilizzano sempre più nanoparticelle che uniscono molecole diagnostiche e farmaci in un unico agente. Le nanoparticelle fungono da vettori per il "carico" molecolare, "ad esempio un farmaco o un radioisotopo per i malati di cancro sottoposti a radioterapia, mirare a percorsi biologici specifici nel corpo del paziente, evitando danni ai tessuti sani.
Una volta raggiunto il loro tessuto bersaglio, le nanoparticelle producono immagini diagnostiche e/o consegnano il loro carico. Questa è la tecnologia all'avanguardia della "nanoterapica, " che è diventato uno dei principali obiettivi della ricerca, anche se con molti limiti da superare.
Ora, il laboratorio di Sandrine Gerber all'EPFL, lavorando con fisici presso l'Università di Ginevra, hanno sviluppato un nuovo sistema nanoteranostico che supera diversi problemi con gli approcci precedenti. Il sistema utilizza "nanoparticelle armoniche" (HNP), una famiglia di nanocristalli di ossido di metallo con eccezionali proprietà ottiche, in particolare la loro emissione in risposta all'eccitazione dalla luce ultravioletta a quella infrarossa, e la loro elevata fotostabilità. È stata questa caratteristica che ha portato gli HNP nella nanoteranostica, quando gli scienziati stavano cercando di risolvere alcuni problemi con le sonde fluorescenti.
"La maggior parte dei sistemi nanoteranostici attivati dalla luce hanno bisogno di luce UV ad alta energia per eccitare i loro scaffold fotosensibili, " dice Gerber. "Il problema è che questo si traduce in una scarsa profondità di penetrazione e può danneggiare cellule e tessuti viventi, che limita le applicazioni biomediche".
Il nuovo sistema sviluppato dal gruppo di Gerber evita questi problemi utilizzando HNP di ferrite di bismuto rivestiti di silice funzionalizzati con carichi molecolari ingabbiati sensibili alla luce. Questi sistemi possono essere facilmente attivati con luce nel vicino infrarosso (lunghezza d'onda 790 nanometri) e acquisiti a lunghezze d'onda maggiori sia per il rilevamento che per i processi di rilascio del farmaco. Entrambe queste caratteristiche rendono il sistema sicuro dal punto di vista medico per i pazienti.
Una volta attivato dalla luce, gli HNP rilasciano il loro carico, in questo caso, L-triptofano, usato come modello. Gli scienziati hanno monitorato e quantificato il rilascio con una tecnica che combina cromatografia liquida e spettrometria di massa, che copre la parte diagnostica per immagini del sistema nanoteranostico.
Gli autori affermano che "questo lavoro è un passo importante nello sviluppo di piattaforme di nanocarrier che consentono l'imaging disaccoppiato in profondità tissutale e il rilascio su richiesta di terapie".