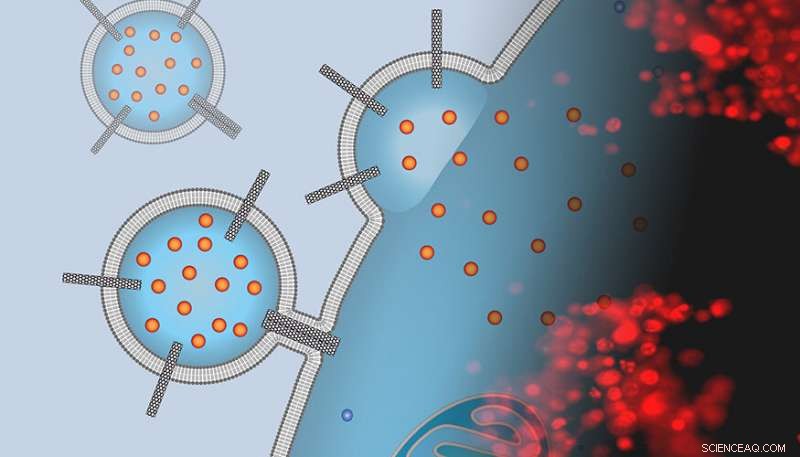
L'immagine è un montaggio della rappresentazione di un artista di un vettore di farmaci liposomiali tempestato di porine di nanotubi di carbonio che si aggancia alla superficie di una cellula cancerosa e fornisce un carico di chemioterapia con un'immagine al microscopio a fluorescenza di cellule colorate esposte a questi vettori. La macchia rossa indica che le cellule sono morte e il trattamento ha avuto successo. Crediti:P. Lastrico di MPI e N.T. Ho e A. Noy di LLNLL
La medicina moderna si basa su un vasto arsenale di farmaci per combattere malattie mortali come la polmonite, tubercolosi, HIV-AIDS e malaria. Gli agenti chemioterapici hanno prolungato la vita di milioni di malati di cancro, e in alcuni casi, ha curato la malattia o l'ha trasformata in una condizione cronica.
Ma portare quei farmaci in cellule affette da malattie è rimasta una sfida importante per la farmacologia e la medicina moderne. Per affrontare questa difficoltà, Gli scienziati e i collaboratori del Lawrence Livermore National Laboratory (LLNL) e dell'Università della California Merced dell'Istituto di biofisica Max Planck in Germania hanno utilizzato nanotubi di carbonio per consentire la somministrazione diretta di farmaci dai liposomi attraverso la membrana plasmatica all'interno della cellula facilitando la fusione della membrana portante con la cella. La ricerca appare in Atti dell'Accademia Nazionale delle Scienze .
I farmaci sono spesso poco solubili, fortemente tossici per altri tessuti o subiscono una rapida degradazione nei diversi ambienti chimici di un organismo. Possono accumularsi nei tessuti non bersaglio, si legano ad altri componenti cellulari o potrebbero non internalizzarsi in modo efficiente nelle cellule bersaglio.
I sistemi di rilascio liposomiale mirano a mitigare questi problemi incapsulando i farmaci in vettori esterni che circolano attraverso il flusso sanguigno. Però, questi sistemi comportano un compromesso tra il miglioramento della stabilità liposomiale sulla strada verso il bersaglio e l'allentamento del rilascio del carico utile nel citosol della cellula bersaglio.
La maggior parte delle attuali strategie di rilascio liposomiale si basa sulla via endosomiale per l'ingresso delle cellule, che è intrinsecamente inefficiente e spesso porta alla degradazione del farmaco. Lipidi cationici comunemente usati, che migliorano la fusione liposomiale con la membrana bersaglio e migliorano la fuga endosomiale, si è rivelato tossico.
"Pensavamo che le porine dei nanotubi di carbonio, brevi pezzi di nanotubi di carbonio inseriti nelle membrane lipidiche, potessero imitare la funzionalità del peptide di fusione virale e aiutare a fondere i trasportatori liposomiali con le membrane delle cellule tumorali, " ha detto lo scienziato Alex Noy, che ha guidato la ricerca presso LLNL.
In una serie di esperimenti, il team ha dimostrato che una semplice piattaforma di nanomateriali, un dimero di porine di nanotubi di carbonio di piccolo diametro (CNTP), funziona come un potente promotore della fusione della membrana. Inoltre, quando Noy e il suo team hanno caricato i loro liposomi con un potente agente chemioterapico (doxorubicina), questi vettori hanno consegnato il farmaco alle cellule tumorali, uccidendone la maggioranza.
"I nostri risultati aprono la strada a vettori di somministrazione di farmaci semplici ed efficienti compatibili con un'ampia gamma di terapie, " ha detto Nga Ho, un ricercatore post-dottorato LLNL e il co-primo autore del documento.
Simulazioni dinamiche molecolari a grana grossa, eseguita dal team di Max Planck, ha rivelato un meccanismo di fusione distinto e insolito in cui i dimeri CNTP legano le vescicole, avvicinare le membrane e poi fondere i loro lembi esterni ed interni.
"Siamo stati molto felici di vedere che la fusione della membrana facilitata da porine di nanotubi di carbonio di piccolo diametro può portare alla completa miscelazione del materiale della membrana e del contenuto interno della vescicola, " ha detto Marc Siggel, uno studente laureato presso Max Planck, e co-primo autore dello studio.
"I nostri esperimenti dimostrano che i liposomi tempestati di CNTP possono fornire la base per costruire il tanto desiderato, ma finora sfuggente, vettore versatile per la somministrazione diretta e altamente efficiente di farmaci e vaccini a DNA e RNA attraverso la membrana plasmatica, "Noi ha detto.
"Questa strategia potrebbe bypassare completamente la via endocitotica e quindi evitare alcuni dei problemi incontrati dalle precedenti strategie di consegna, " ha aggiunto Gerhard Hummer, un biofisico teorico al Max Planck Institute, che ha guidato lo sforzo di modellazione.