
Le nanofibre di RNA-DNA sono state progettate per legare e inattivare la trombina e grazie alle loro dimensioni hanno una circolazione prolungata nel flusso sanguigno. Questo processo di anticoagulazione indotto può essere invertito dal meccanismo del kill switch che si traduce anche nella produzione di complessi più piccoli per l'escrezione renale accelerata. Credito:UNC Charlotte
Mentre la coagulazione del sangue è importante per prevenire la perdita di sangue e per la nostra immunità, la coagulazione può anche causare problemi di salute e persino la morte. Attualmente, una persona su quattro nel mondo muore per malattie e condizioni causate da coaguli di sangue. Nel frattempo, gli anticoagulanti utilizzati per ridurre i rischi possono anche causare problemi significativi, come sanguinamento incontrollato.
Ora, una nuova piattaforma anticoagulante biomolecolare inventata da un team guidato dal ricercatore dell'UNC Charlotte Kirill Afonin è promettente come un progresso rivoluzionario rispetto ai fluidificanti del sangue attualmente utilizzati durante gli interventi chirurgici e altre procedure. Le scoperte del team sono riportate nella rivista Nano Letters , disponibile per la prima volta online il 5 luglio.
"Prevediamo che gli usi della nostra nuova piattaforma anticoagulante sarebbero durante gli interventi chirurgici di bypass coronarico, la dialisi renale e una varietà di interventi vascolari, chirurgici e coronarici", ha affermato Afonin. "Stiamo ora studiando se ci sono potenziali applicazioni future con trattamenti contro il cancro per prevenire le metastasi e anche per affrontare i bisogni della malaria, che può causare problemi di coagulazione".
L'articolo condivide i risultati più recenti di tre anni di collaborazione tra ricercatori con il Frederick National Laboratory for Cancer Research (Nanotechnology Characterization Laboratory), l'Università di San Paolo in Brasile, la Pennsylvania State University e l'Uniformed Services University of the Health Sciences.
"Tutto ciò ha portato a un enorme sforzo internazionale e interdisciplinare per sviluppare una tecnologia completamente nuova che riteniamo possa rivoluzionare il campo ed essere ripresa da altre aree della ricerca sanitaria", ha affermato Afonin.
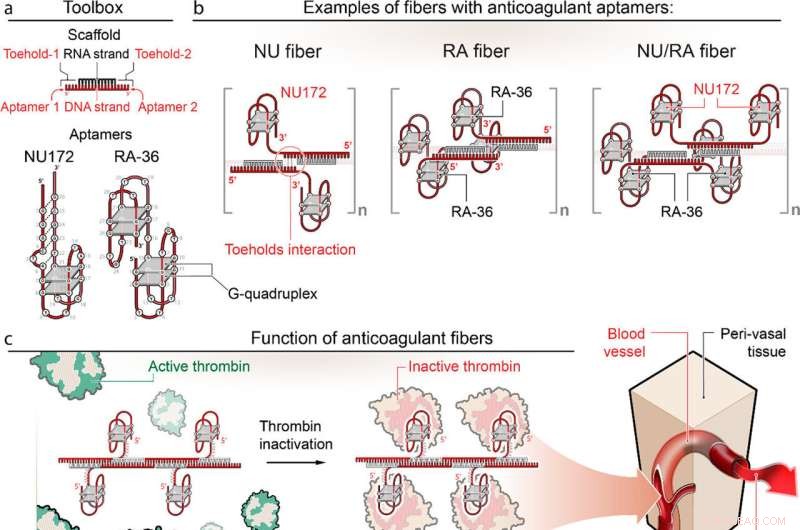
(a, b) Progettazione di fibre anticoagulanti che trasportano aptameri NU172 e RA-36 con tre possibili posizioni aptameriche all'interno delle fibre indicate. (c) Legame delle fibre anticoagulanti alla trombina, prevenendo la cascata di coagulazione del sangue. (d) Legame dei kill-switch alle fibre anticoagulanti, causando il ripristino della funzione della trombina e producendo gruppi più piccoli per l'escrezione renale accelerata. Credito:UNC Charlotte
La tecnologia del team si rivolge a fibre anticoagulanti RNA-DNA programmabili che, una volta iniettate nel flusso sanguigno, formano strutture modulari che comunicano con la trombina, che sono gli enzimi nel plasma sanguigno che causano la coagulazione del sangue. La tecnologia consente alle strutture di prevenire la coagulazione del sangue quando necessario, per poi essere rapidamente eliminate dall'organismo dal sistema renale una volta terminato il lavoro.
Le strutture delle fibre utilizzano aptameri, brevi sequenze di DNA o RNA progettate per legare e inattivare la trombina in modo specifico.
"Invece di avere una singola piccola molecola che disattiva la trombina", ha detto Afonin, "ora abbiamo una struttura relativamente grande che ha centinaia di aptameri sulla sua superficie che possono legarsi alla trombina e disattivarli. E poiché la struttura diventa più grande, diventa circolerà nel sangue per un tempo significativamente più lungo rispetto alle opzioni tradizionali."
La circolazione prolungata nel flusso sanguigno consente una singola iniezione, invece di dosi multiple. Il design riduce anche la concentrazione di anticoagulanti nel sangue, con conseguente minore stress sul sistema renale e su altri sistemi del corpo, ha affermato Afonin.
Questa tecnologia introduce anche un nuovo meccanismo "kill-switch". Una seconda iniezione inverte la funzione anticoagulante della struttura della fibra, consentendo alle fibre di metabolizzarsi in materiali minuscoli, innocui, inattivi e facilmente escreti dal sistema renale.
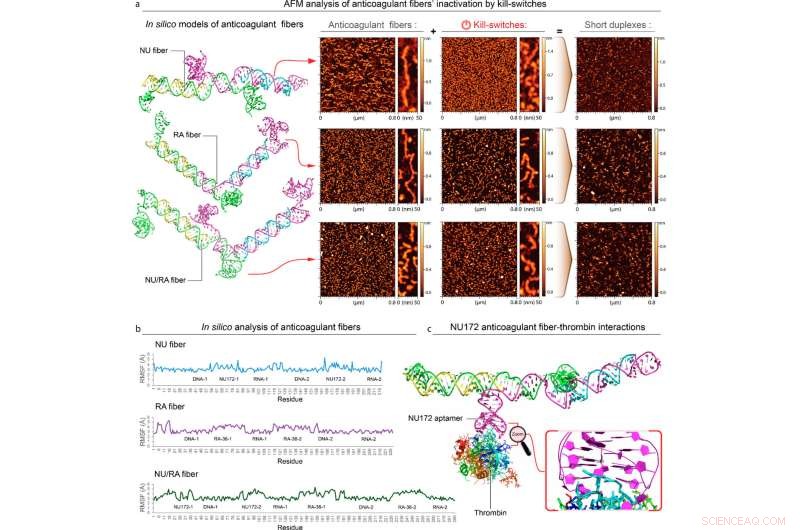
(a) Strutture 3D previste e immagini AFM di fibre, kill-switch e loro prodotti di riassociazione. Sulla base dei modelli sono state stimate le distanze tra gli aptameri in ciascuna struttura (Tabella S1). (b) Fluttuazione del quadrato medio (RMSF) di fibre NU, RA e NU/RA e (c) interazioni modellate di fibre NU e trombina. I residui numerati indicano dove si verificano le interazioni. Credito:UNC Charlotte
L'intero processo avviene al di fuori della cellula, attraverso la comunicazione extracellulare con la trombina. I ricercatori osservano che questo è importante in quanto non sembrano verificarsi reazioni immunologiche, sulla base dei loro studi approfonditi.
Il team ha testato e convalidato la piattaforma utilizzando modelli informatici, sangue umano e vari modelli animali. "Abbiamo condotto studi proof-of-concept utilizzando sangue umano appena raccolto da donatori negli Stati Uniti e in Brasile per affrontare una potenziale variabilità tra i donatori", ha affermato Afonin.
La tecnologia potrebbe fornire una base per altre applicazioni biomediche che richiedono la comunicazione attraverso l'ambiente extracellulare nei pazienti, ha affermato. "La trombina è solo una potenziale applicazione", ha detto. "Qualunque cosa tu voglia disattivare extracellulare, senza entrare nelle cellule, crediamo che tu possa. Ciò significa potenzialmente che qualsiasi proteina del sangue, qualsiasi recettore della superficie cellulare, forse anticorpi e tossine, sono possibili."
La tecnica consente la progettazione di strutture di qualsiasi forma desiderata, con il meccanismo del kill switch intatto. "Cambiando la forma, possiamo farli entrare in diverse parti del corpo, così possiamo cambiare la distribuzione", ha detto Afonin. "Ottiene un ulteriore livello di raffinatezza di ciò che può fare."
Sebbene l'applicazione sia sofisticata, la produzione delle strutture è relativamente semplice. "La durata di conservazione è sorprendentemente buona per queste formulazioni", ha affermato Afonin. "Sono molto stabili, quindi puoi asciugarli e prevediamo che rimarranno per anni a temperatura ambiente, il che li rende molto accessibili alle aree del mondo economicamente difficili."
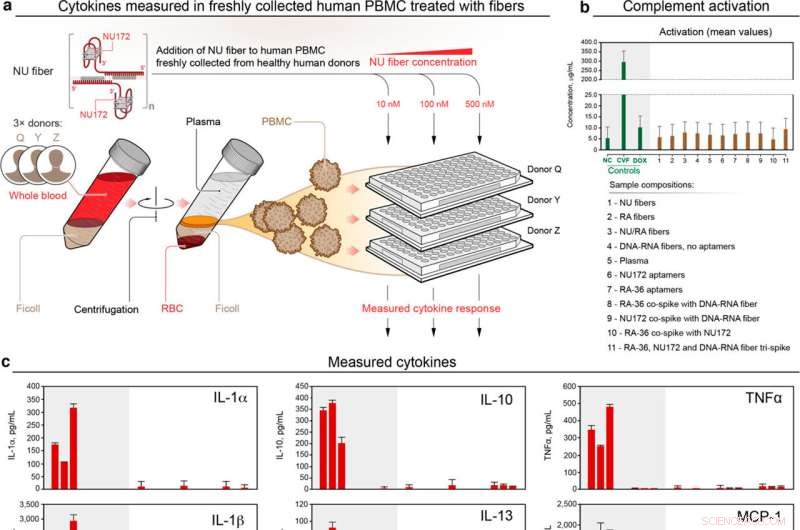
(a) Schema del flusso sperimentale. (b) attivazione del complemento e (c) citochine prodotte in risposta a fibre anticoagulanti e aptameri valutati in PBMC umane appena isolate dal sangue di donatori sani. I dati sono mostrati come media ± DS, N =2 ripetizioni per N =3 donatori. La significatività statistica delle fibre NU rispetto alle cellule non trattate (NC) è indicata da un asterisco (p <0,05). Credito:UNC Charlotte
Sebbene il lavoro dei ricercatori finora abbia rilevanza per applicazioni a breve termine, come negli interventi chirurgici, sperano di estendere la loro ricerca a situazioni di manutenzione, come con i farmaci che assumono i pazienti con problemi cardiaci.
Il potenziale per salvare vite umane e migliorare l'assistenza sanitaria è una motivazione per il team, così come inventare qualcosa di nuovo, ha affermato Afonin. "Possiamo imparare dalla natura, ma abbiamo costruito qualcosa che non è mai stato introdotto prima", ha detto. "Quindi, sviluppiamo e costruiamo tutte queste piattaforme de novo, da zero. E poi possiamo spiegare attraverso le nostre piattaforme cosa vogliamo che la natura, o il nostro corpo, faccia e il nostro corpo ci capisca."
L'Office of Research Commercialization and Development dell'UNC Charlotte sta lavorando a stretto contatto con Penn State per brevettare e portare questa nuova tecnologia sul mercato. + Esplora ulteriormente