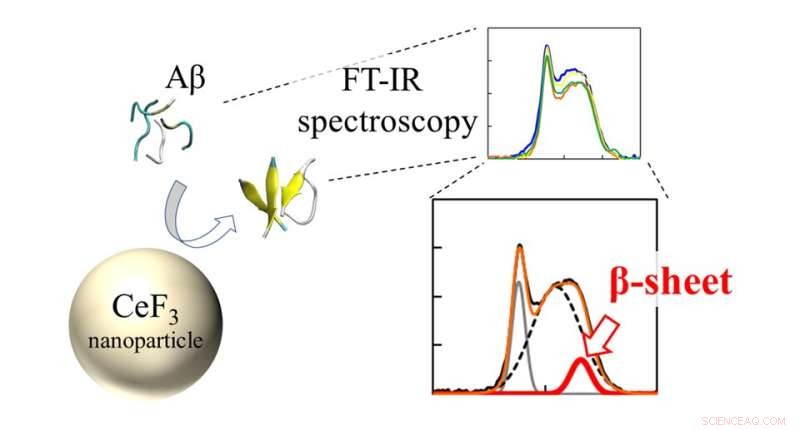
Gli spettri a infrarossi (FT-IR) e il rapporto β-foglio dei peptidi Aβ hanno interagito con le NP CeF3. L'effetto delle nanoparticelle di CeF3 sulla struttura della proteina beta amiloide viene misurato direttamente con la spettroscopia FT-IR. La formazione della struttura secondaria si presenta come una caratteristica nello spettro IR. Credito:Masakazu Umezawa / Tokyo University of Science, Tipo di licenza:CC BY 4.0
La funzione e l'attività delle proteine sono determinate sia dal loro assemblaggio che dalla struttura secondaria. Anomalie legate all'aggregazione proteica o alla struttura secondaria possono portare a malattie neurodegenerative. In un nuovo studio, un team di ricerca internazionale rivela come le nanoparticelle di fluoruro, materiali utilizzati nell'imaging in vivo, influenzino l'assemblaggio e la struttura della proteina β amiloide. I loro risultati rappresentano un passo avanti verso un migliore trattamento e prevenzione dei disturbi neurologici come il morbo di Alzheimer.
L'autoassemblaggio, o l'associazione di singole unità di un materiale in strutture o modelli ordinati, è un fenomeno di grande interesse di ricerca per gli scienziati dei materiali. Un importante esempio di autoassemblaggio viene dall'autoassemblaggio di proteine nei sistemi biologici. La funzione e l'attività delle proteine sono regolate dal loro stato di assemblaggio. Inoltre, svolge un ruolo anche la "struttura secondaria" della proteina, caratterizzata dal suo ripiegamento in strutture, come un foglio β. Infatti, anomalie nelle strutture secondarie delle proteine o nel loro assemblaggio possono portare a varie malattie neurodegenerative, tra cui il morbo di Alzheimer.
Le nanoparticelle (NP) offrono un percorso promettente per il trattamento e la prevenzione di tali malattie consentendo una somministrazione controllata e mirata di farmaci. Inoltre, le NP inorganiche, come le NP di fluoruro, sono utilizzate nelle applicazioni di imaging cerebrale. Rispetto alle NP organiche, le NP inorganiche sono considerate un candidato migliore per lo sviluppo di materiali ad alta funzionalità. Ma c'è molta preoccupazione per quanto riguarda la loro biotossicità. Sebbene le loro interazioni con le bioproteine siano state studiate, il meccanismo alla base di queste interazioni non è ben compreso.
Un team internazionale di scienziati dell'Università della Scienza di Tokyo (TUS) in Giappone e dell'Università di Nazarbayev in Kazakistan ha ora affrontato questo problema. Nel loro studio, che è stato reso disponibile online il 2 giugno 2022, ed è stato pubblicato sulla rivista ACS Applied Bio Materials il 20 giugno 2022, il team ha studiato una sezione del peptide β amiloide (una proteina che si trova nelle placche che si formano nel cervello dei pazienti con malattia di Alzheimer) in una soluzione con ceramica al fluoro (CeF3 ) NP. Lo studio è stato condotto dal Professore Associato Junior Masakazu Umezawa e includeva i contributi del Sig. Naoya Sakaguchi del TUS e degli Assistenti Professori Mehdi Amouei Torkmahalleh e Dhawal Shah dell'Università di Nazarbayev.
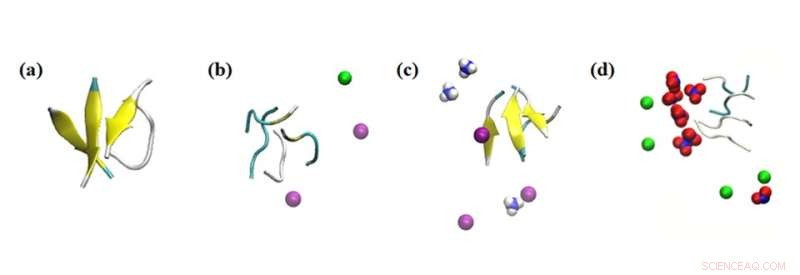
Istantanee di simulazione delle interazioni dell'aggregato peptidico con vari ioni. Risultati della simulazione dell'effetto degli ioni entro 0,1 nm sui peptidi nei sistemi in studio:(a) nessun sale, (b) 0,15 M NaCl, (c) 0,15 M NH4Cl e (d) 0,15 M NaNO3. Colorazione:foglio beta =giallo; Na+ =verde; NH4+ =blu e bianco; Cl- =viola; e NO3− =blu e rosso. Credito:Masakazu Umezawa / Tokyo University of Science, Tipo di licenza:CC BY 4.0
Il team ha utilizzato una tecnica chiamata "spettroscopia infrarossa a trasformata di Fourier" (FTIR) per monitorare direttamente l'effetto della superficie NP sui legami peptidici. "Abbiamo scoperto che vicino alla superficie delle nanoparticelle, è più probabile che i peptidi formino fogli β. Ciò si verifica come effetto dell'idrofobicità. Le parti del peptide che sono respinte dalla soluzione acquosa si attaccano alle nanoparticelle e formano aggregati più facilmente". spiega il dottor Umezawa.
Inoltre, il team ha studiato l'effetto di altri ioni circostanti nella soluzione. "Quello che abbiamo trovato è stato molto sorprendente. Anche senza le nanoparticelle, l'ambiente ha influenzato il tasso di formazione della struttura secondaria", afferma il dott. Umezawa, "Questo effetto, risultante da una combinazione di interazione elettrostatica e legame idrogeno, è stato esagerato con l'aggiunta di nanoparticelle. Con un'attenta scelta di ioni e nanoparticelle, la formazione del foglio β può essere soppressa o promossa. Ciò implica che il processo può essere controllato e ingegnerizzato per sradicare gli effetti avversi."
I risultati sperimentali sono stati integrati con simulazioni di dinamica molecolare eseguite dal team dell'Università di Nazarbayev. Questo, a sua volta, ha aiutato a progettare e guidare gli esperimenti, oltre a fornire informazioni dettagliate sui risultati.
Con questa comprensione più profonda dell'interazione tra proteine e NP, lo studio apre la strada a processi di ripiegamento proteico controllato. Con tale controllo, qualsiasi deformazione proteica potrebbe essere eliminata e potrebbero essere promosse interazioni positive e cambiamenti strutturali. Ciò potrebbe portare a un migliore protocollo di prevenzione e trattamento per il morbo di Alzheimer e, infine, a una migliore qualità della vita per gli anziani. + Esplora ulteriormente