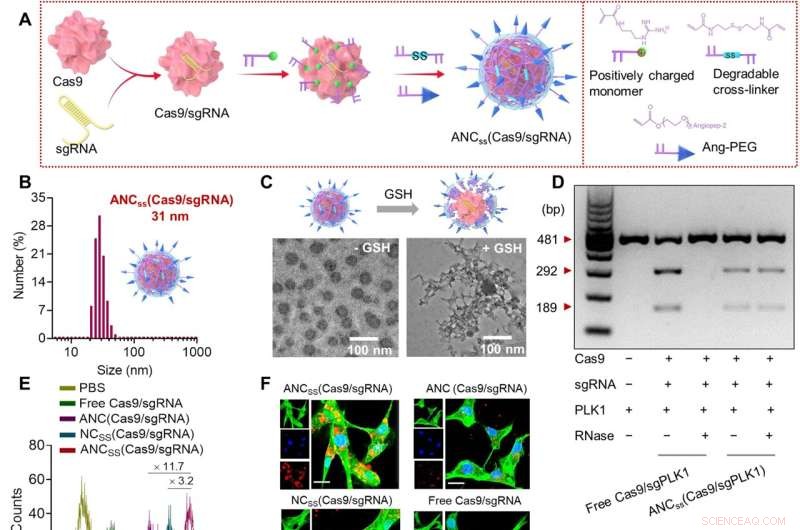
Fabbricazione, proprietà fisiche e funzione cellulare delle nanocapsule Cas9/sgRNA. (A) La polimerizzazione dei radicali liberi in situ è stata utilizzata per sintetizzare nanocapsule reticolate con disolfuro contenenti Cas9/sgRNA e funzionalizzate con ligando di targeting angiopep-2. (B) Distribuzione dimensionale di ANCSS (Cas9/sgRNA) nanocapsule determinate dalla diffusione dinamica della luce. (C) Immagini TEM di ANCSS (Cas9/sgRNA) con o senza trattamento con GSH. (D) Analisi dell'elettroforesi su gel dell'ANCSS (Cas9/sgPLK1) o Cas9/sgPLK1 libero con o senza trattamento con RNasi (1 mg/ml, 30 min). (E) Citometria a flusso di cellule U87MG dopo 4 ore di incubazione con ANCSS (Cas9/sgRNA) o controlli. (F) Immagini al microscopio confocale a scansione laser (CLSM) di cellule U87MG dopo 4 ore di incubazione con ANCSS (Cas9/sgRNA) o controlli. Cas9 è stato etichettato con Alexa Fluor 647 (AF647; rosso); il citoscheletro è stato colorato con Alexa Fluor 488 (verde) e i nuclei sono stati colorati con Hoechst 33342 (blu). Per (E) e (F), la concentrazione di AF647-Cas9 era di 20 nM. Barre di scala, 20 μm. (G) Efficienza di modifica del gene della luciferasi nelle cellule U87MG-Luc incubate con ANCSS (Cas9/sgRNA) o controlli per 72 ore. I dati sono presentati come medie ± DS (n =5; *P <0,05, **P <0,01 e ***P <0,001). (H) Indels del gene PLK1 in cellule U87MG trasfettate con ANCSS (Cas9/sgPLK1) o controlli per 48 ore. (I) Schema dell'editing genetico nel nucleo. (J) Livelli di espressione di PLK1 nelle cellule U87MG dopo 72 ore di incubazione con ANCSS (Cas9/sgPLK1) o controlli. (K) Saggio di apoptosi delle cellule U87MG dopo 72 ore di incubazione con ANCSS (Cas9/sgRNA) e altri controlli. Da (G) a (K), la concentrazione di Cas9 era 20 nM. bp, coppie di basi; PBS, soluzione salina tamponata con fosfato. Credito:Progressi scientifici (2022). DOI:10.1126/sciadv.abm8011
Un team internazionale di ricercatori ha sviluppato una nanocapsula in grado di attraversare la barriera ematoencefalica (BBB) per trasportare lo strumento di editing CRISPR-Cas9 per il trattamento di un tumore al cervello. Nel loro articolo pubblicato sulla rivista Science Advances, il gruppo descrive come hanno creato la loro capsula e come ha funzionato quando è stata testata su topi con un glioblastoma.
I glioblastomi sono notoriamente difficili da trattare. I tumori compaiono nel cervello e la loro crescita danneggia i tessuti. Le opzioni di trattamento includono la rimozione chirurgica, le iniezioni dirette di terapie destinate a uccidere le cellule tumorali o l'inserimento di virus CRISPR nel flusso sanguigno. Ognuna di queste opzioni ha uno svantaggio, dal tessuto cerebrale danneggiato all'inefficacia a causa delle difficoltà con le terapie che attraversano il BBB. In questo nuovo sforzo, i ricercatori hanno provato un nuovo approccio, utilizzando una nanocapsula per trasportare lo strumento di editing CRISPR-Cas9 sul tumore al cervello dove mira a un gene responsabile dello sviluppo di nuove cellule, una capsula in grado di attraversando il BBB.
Il guscio della nanocapsula è stato creato utilizzando un polimero disolfuro reticolato che è stato poi punteggiato con un peptide angiopep-2. Il peptide è stato aggiunto per creare una carica superficiale neutra in modo che non venisse attaccato dalla ribonucleasi. Il guscio era abbastanza grande da contenere un complesso Cas9 ma ancora abbastanza piccolo (circa 30 nanometri di lunghezza) da consentirgli di passare attraverso il BBB.
I ricercatori hanno testato il loro sistema di somministrazione di nanocapsule in modelli murini di glioblastoma. A ciascuno è stata somministrata una singola iniezione di coda:alcuni hanno ricevuto il sistema di somministrazione di nanocapsule di nuova concezione mentre altri hanno ricevuto un controllo. I ricercatori hanno scoperto che i topi sottoposti alla nuova terapia avevano un tempo medio di sopravvivenza di 68 giorni rispetto ai 24 giorni del gruppo di controllo. Hanno anche riscontrato un tasso di mutazione genetica indesiderata inferiore allo 0,5% in altri tessuti cerebrali.
I ricercatori suggeriscono che il loro lavoro rappresenta un nuovo passo verso approcci non invasivi e non virali per il trattamento dei glioblastomi, anche se riconoscono che è necessario fare molto più lavoro prima di poter determinare se lo stesso approccio sarà sicuro ed efficace negli esseri umani. + Esplora ulteriormente
© 2022 Rete Science X