
Tecnica 3D nanoendoscopia-AFM. (A) Schema del metodo 3D nanoendoscopia-AFM, in cui la nanosonda viene introdotta ripetutamente all'interno della cellula in diverse posizioni nell'area desiderata. (B) Nanosonda fabbricata da FIB utilizzata nelle misurazioni 3D di nanoendoscopia-AFM. (C e D) Tipiche curve F-z ottenute penetrando in una cellula, dove una brusca diminuzione della deflessione a sbalzo è rappresentata come un picco quando la nanosonda penetra nella membrana cellulare esterna (C), apparendo come un altro picco nel caso in cui la nanosonda fori la membrana nucleare (D). (G) Mappa cellulare 3D nanoendoscopia-AFM dell'intero volume cellulare HeLa (40 × 40 × 6 μm3) racchiuso nel quadrato rosso in (E), dove è possibile distinguere la membrana cellulare, il nucleo e le regioni citoplasmatiche nella sezione trasversale visualizzato in (H). (I) Immagine 3D di nanoendoscopia-AFM di un volume cellulare HeLa (10 × 10 × 6 μm3) racchiuso nel quadrato rosso in (F), dove le strutture granulari interne possono essere chiaramente riconosciute. Credito:Progressi scientifici , 10.1126/sciadv.abj4990
La microscopia a forza atomica (AFM) offre un metodo per l'imaging senza etichetta della dinamica biomolecolare su scala nanometrica per risolvere questioni biologiche che non possono essere affrontate tramite altri metodi di bioimaging, tra cui la fluorescenza e la microscopia elettronica a scansione. Poiché tali metodi di imaging sono possibili solo per sistemi biologici estratti da cellule o ricostruiti su substrati solidi, la nanodinamica all'interno delle cellule viventi rimane in gran parte inaccessibile con i metodi di bioimaging esistenti. In un nuovo rapporto ora pubblicato in Science Advances , Marcos Penedo e un gruppo di ricerca in Nanolife Science e biotecnologie presso l'Università di Kanazawa in Giappone, hanno superato i limiti del bioimaging utilizzando la nanoendoscopia-AFM. Durante il processo, hanno inserito una sonda aghiforme in una cellula vivente per presentare la fibra di actina, mappe tridimensionali (3D) e nanodinamica 2D dell'impalcatura interna della membrana con cambiamenti non rilevabili nella vitalità cellulare. A differenza dei precedenti metodi AFM, la nanosonda accedeva direttamente ai componenti intracellulari target ed esplorava le capacità dell'AFM, tra cui l'imaging ad alta risoluzione, la mappatura nanomeccanica e il riconoscimento molecolare per espandere la gamma osservabile delle strutture intracellulari nelle cellule viventi.
Dinamica intracellulare di bioimaging
La dinamica su scala molecolare dei componenti intracellulari fornisce informazioni sui meccanismi fondamentali delle funzioni cellulari e della malattia. Tuttavia, i metodi di imaging diretto per tale nanodinamica nelle cellule viventi sono impegnativi. Ad esempio, mentre la microscopia elettronica è utile per l'immagine di nanostrutture di cellule congelate nel vuoto, non sono in grado di visualizzare la nanodinamica nelle cellule viventi in ambienti fisiologici, tranne che come istantanee statiche di conformazioni fisse. Allo stesso modo, mentre la microscopia a fluorescenza tramite l'etichettatura a fluorescenza fornisce un metodo potente per visualizzare la dinamica di proteine e organelli nelle cellule viventi, sono limitati dall'incapacità di immagini in modo efficiente su scala nanometrica. Esistono quindi forti richieste per un metodo di imaging intracellulare senza etichetta in ambienti liquidi. La microscopia a forza atomica (AFM) è un potenziale candidato per il ruolo con la capacità di acquisire immagini su scala sub-nanometrica per visualizzare la nanodinamica di lipidi, proteine e DNA senza etichette. Tuttavia, tali immagini non sono rappresentative di sistemi biologici come risultato dell'estrazione da una cellula o della ricostruzione su un substrato solido in vitro. In questo lavoro, quindi, Penedo et al. ha proposto un metodo di imaging basato su AFM noto come nanoendoscopia-AFM per osservare la nanodinamica all'interno delle cellule viventi senza etichettarle o dividerle.
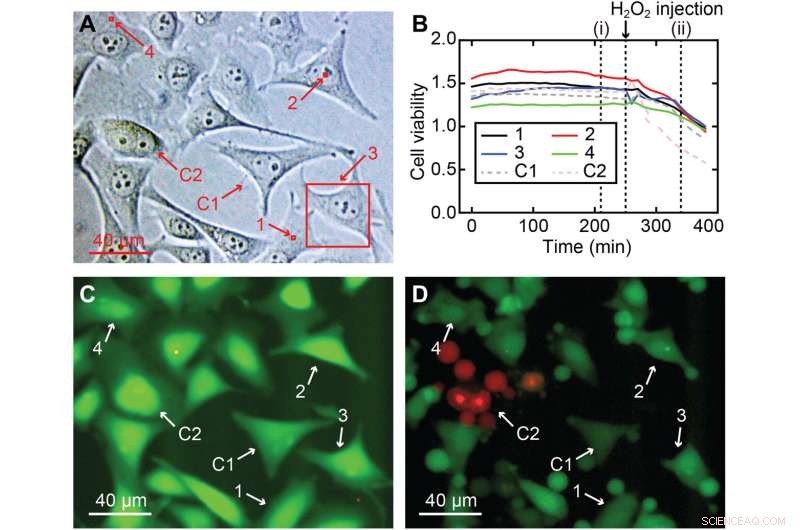
Vitalità cellulare delle misurazioni 3D nanoendoscopia-AFM. (A) Diverse aree misurate eseguite in una coltura cellulare HeLa per il test di vitalità cellulare, comprese le regioni del nucleo e della periferia cellulare:(1) 2 × 2 × 7 μm3, (2) 2 × 2 × 10 μm3, (3) 40 × 40 × 8 μm3 e (4) 2 × 2 × 7 μm3, evidenziati in quadrati rossi; due cellule sono state utilizzate come controllo, C1 e C2. (B) Rapporti di vitalità cellulare nel tempo per le quattro cellule con imaging (da 1 a 4) e per le due cellule utilizzate come controllo (C1 e C2), mostrando che tutte le cellule (con imaging e controllo) avevano un'intensità di vitalità cellulare piatta simile rapporto e confermando che le cellule non erano gravemente danneggiate. (C) Esempio di un'immagine a fluorescenza dopo 210 min corrispondente a (i) in (B), dove il colore verde intenso indica una normale attività esterasi prevista per una cellula viva. Per verificare la validità del test, H2O2 è stato aggiunto dopo 260 minuti al mezzo per uccidere le cellule, con conseguente diminuzione dei rapporti di vitalità cellulare di tutte le cellule, una chiara indicazione che le cellule stavano morendo. (D) Istantanea di fluorescenza corrispondente al tempo (ii) in (B), dove i segni di danno sono chiaramente visibili in tutte le cellule, la maggior parte delle quali ha già subito un restringimento o apoptosi. Credito:Progressi scientifici , 10.1126/sciadv.abj4990
Esperimenti di nanoendoscopia-AFM
Durante gli esperimenti, proprio come una fotocamera endoscopica, i ricercatori hanno inserito una lunga nanosonda a forma di ago all'interno di una cellula vivente per eseguire l'imaging AFM 2D e 3D. Il team ha mostrato come la nanoendoscopia-AFM fornisse un vantaggio unico per l'imaging intracellulare di cellule vive senza etichetta su scala nanometrica. Il metodo fornisce un potente percorso per osservare fenomeni finora inesplorati nei sistemi biologici. Penedo et al. ha introdotto ripetutamente la nanosonda all'interno della cella in diverse posizioni dell'area desiderata tramite misurazioni della curva di forza rispetto alla distanza. Per visualizzare l'intera cellula, la nanosonda doveva essere abbastanza lunga da penetrare completamente nella cellula fino a raggiungere il substrato e con diametri inferiori a 200 nm per ridurre al minimo il danno cellulare, facilitando al contempo la penetrazione della membrana. Il team ha utilizzato una punta tetraedrica in silicio commerciale come nanosonda, che ha fresato utilizzando la fresatura a fascio ionico focalizzato alle dimensioni preferite. Il team ha quindi utilizzato le nanosonde all'interno di diverse aree di una cellula HeLa. Hanno acquisito un'immagine 3D di nanoendoscopia-AFM di un'intera cellula durante gli esperimenti e hanno identificato il nucleo della cellula HeLa dal resto della cellula. Ulteriori misurazioni hanno indicato anche le strutture granulari interne. Per ridurre al minimo il danno cellulare durante la penetrazione, Penedo et al. ridotto il più possibile la forza di penetrazione e la lunghezza della rientranza. Hanno anche condotto esperimenti di vitalità cellulare per confermare che la nanoendoscopia 3D-AFM non ha portato a gravi danni cellulari quando si utilizzano nanosonde con diametri inferiori a 200 nm. Utilizzando la nanoendoscopia 3D-AFM, hanno facilitato l'imaging del citoscheletro interno nelle cellule viventi per osservare l'organizzazione 3D delle fibre non supportate. Il team ha anche unito con successo le immagini intracellulari risultanti dalla nanoendoscopia 3D-AFM e dalla microscopia confocale.

Combinazione di imaging confocale e nanoendoscopia 3D-AFM. (A) Immagine di fluorescenza confocale in cui sono visibili i filamenti di actina macchiati. (B) L'immagine ingrandita ottenuta nell'area indicata dal quadrato rosso in (A). (C e D) Mappe 3D nanoendoscopia-AFM delle fibre di actina del citoscheletro ottenute nell'area evidenziata dal quadrato rosso in (B), dove le posizioni verticali Z dei diversi filamenti di actina (frecce rosse) e le membrane cellulari superiori e inferiori vengono contemporaneamente risolti. L'immagine semitrasparente mostrata nel quadrato rosso in (B) corrisponde alla proiezione 2D delle mappe 3D mostrate in (C) e (D). Credito:Progressi scientifici , 10.1126/sciadv.abj4990
Nanoendoscopia 2D-AFM
La capacità di inserire una lunga nanosonda in una cellula molte volte mantenendo la vitalità cellulare implicava la possibilità di individuare l'apice della sonda all'interno di una cellula vivente per eseguire misurazioni AFM 2D/3D locali senza danni sostanziali. La nanosonda potrebbe essere inserita all'interno della cellula per misurare il lato citoplasmatico della membrana cellulare tramite la modalità di modulazione di ampiezza AFM. Le nanosonde dovevano essere abbastanza lunghe da penetrare completamente nella cellula e raggiungerne il fondo, pur essendo abbastanza sottili da ridurre il danno cellulare. Per ottenere ciò in pratica, Penedo et al. ha sviluppato nanosonde fatte di carbonio amorfo utilizzando la deposizione di fasci di elettroni e ha misurato la dipendenza dell'ampiezza dalla distanza, per determinare l'integrità della cellula. Hanno eseguito esperimenti di nanoendoscopia 2D-AFM utilizzando una cellula di fibroblasti per illustrare la struttura reticolare della membrana cellulare interna e hanno osservato l'architettura cellulare per studiare la dinamica interna delle strutture cellulari. Il lavoro ha evidenziato la possibilità di utilizzare la nanoendoscopia 2D-AFM per studiare la nanodinamica delle strutture interne nelle cellule viventi in ambienti fisiologici.

Tecnica 2D nanoendoscopia-AFM. (A) Illustrazione del metodo 2D nanoendoscopia-AFM, in cui la nanosonda viene inserita all'interno della cellula per misurare il lato citoplasmatico della membrana cellulare mediante la modalità di modulazione di ampiezza AFM. (B) Esempio di una nanosonda fabbricata con EBD utilizzata nella nanoendoscopia 2D-AFM, in cui la lunghezza dell'ago dovrebbe essere abbastanza lunga da penetrare completamente nella cellula e raggiungere la sua parte inferiore e abbastanza sottile da ridurre il danno cellulare. (C) Forza registrata (in alto) e ampiezza (in basso) rispetto alle curve di distanza per localizzare con precisione le membrane cellulari superiori e inferiori:la forza verticale è nulla quando la nanosonda è lontana, aumentando non appena la nanosonda tocca la membrana cellulare superiore; in seguito, presenta un plateau che corrisponde al dominio citoplasmatico interno fino a quando la curva aumenta di nuovo bruscamente quando la nanosonda raggiunge la membrana cellulare inferiore. Il punto di regolazione dell'ampiezza per la regolazione della distanza punta-campione deve essere sufficientemente basso da garantire che la punta tocchi la superficie inferiore della cella. (F) Immagini consecutive di nanoendoscopia 2D-AFM 1 μm × 1 μm eseguite su un fibroblasto BALB/3T3 nella regione evidenziata dal punto rosso raffigurato in (D), che mostra la struttura reticolare della superficie interna della membrana cellulare che forma la sua impalcatura e anche le fluttuazioni della membrana durante le misurazioni. (G) Area ingrandita delle immagini visualizzate in (F), tracciando una sezione tra i punti A e B (E), dove due sporgenze separate da 25 nm sono chiaramente risolte nell'immagine. Credito:Progressi scientifici , 10.1126/sciadv.abj4990
Prospettiva
In questo modo, Marcos Penedo e colleghi hanno mostrato le applicazioni della nanoendoscopia-AFM per misurare le superfici interne citoplasmatiche delle membrane cellulari e gli scaffold associati per comprendere la disposizione 3D dei filamenti di actina nel loro ambiente intracellulare naturale nelle cellule viventi. Il team ha cercato di ridurre al minimo il danno cellulare utilizzando nanosonde ultrasottili simili ad aghi negli esperimenti. I metodi AFM proposti hanno prodotto mappe 3D delle strutture cellulari interne oltre a proiezioni 2D combinate con metodi di fluorescenza esistenti come la microscopia confocale o a super risoluzione. Il metodo farà luce sul macchinario cellulare in azione, in vivo, esponendo motori molecolari fisiologici. Il metodo aprirà anche nuove possibilità per studiare la nanomeccanica intracellulare che svolge un ruolo importante nelle funzioni cellulari. Il team può utilizzare il metodo per misurare le caratteristiche di rigidità, adesione e dissipazione del nucleo per estrarre informazioni biologiche adatte ai campi interdisciplinari della biologia cellulare e della medicina. + Esplora ulteriormente
© 2022 Rete Science X