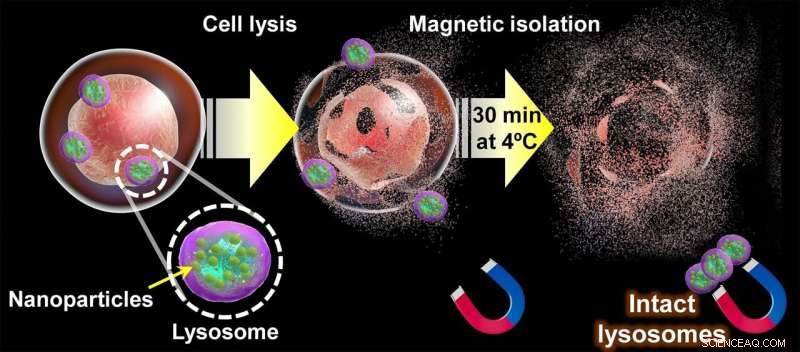
Diagramma dell'approccio proposto per l'estrazione di lisosomi intatti. Una volta che le nanoparticelle magnetiche si sono accumulate naturalmente nei lisosomi di una cellula attraverso la via endocitica, la membrana cellulare si rompe. e il suo contenuto "setacciato" per 30 minuti usando i magneti. Al termine di questo processo, i lisosomi intatti possono essere recuperati dai magneti e utilizzati per studiarne la struttura, i metaboliti e la composizione proteica. Credito:Shinya Maenosono
Il corretto funzionamento delle cellule si basa sulla precisa orchestrazione di molti processi e organelli complessi. I lisosomi, gli organelli cellulari vitali, sono subunità piene di enzimi che si trovano all'interno di molte cellule animali che aiutano a scomporre e riutilizzare le macromolecole, come proteine, lipidi e nucleotidi. Oltre alla loro funzione nella digestione cellulare e nella gestione dei rifiuti, i lisosomi partecipano anche alla segnalazione degli aminoacidi, che stimolano la sintesi proteica insieme ad altri effetti.
Dato che molte malattie sono causate da difetti nella funzione dei lisosomi, non sorprende che i ricercatori abbiano cercato attivamente di comprendere questi organelli per decenni. Ma ci sono solo poche tecniche che consentono l'estrazione di lisosomi dall'interno di una cellula. Il metodo più comune è chiamato "ultracentrifugazione a gradiente di densità". Implica la rottura delicata della membrana cellulare e l'applicazione di una forza centrifuga al contenuto della cellula. Questo separa i componenti cellulari per densità. Sfortunatamente, alcuni altri organelli hanno la stessa densità dei lisosomi, risultando in campioni con impurità. Inoltre, il processo richiede così tanto tempo che, al termine, molte proteine lisosomiali sono già state perse e/o degradate.
Una tecnica più avanzata, chiamata "immunoprecipitazione", si basa sulla modifica delle proteine di superficie dei lisosomi in modo che possano essere catturate da sfere magnetiche ricoperte da anticorpi appositamente studiati. Sebbene questo approccio produca risultati più puri, la composizione proteica dei lisosomi estratti viene modificata dalla procedura e, quindi, le successive analisi proteiche possono essere compromesse. È chiaro, quindi, che dobbiamo trovare un modo migliore per estrarre i lisosomi dalle cellule.
Fortunatamente, un team di scienziati guidato dal Prof. Shinya Maenosono del Japan Advanced Institute of Science and Technology (JAIST) si è fatto avanti e ha sviluppato una nuova strategia per separare rapidamente i lisosomi intatti con elevata purezza. Questo studio è stato pubblicato su ACS Nano e includevano anche il Prof. Kazuaki Matsumura e il Prof. Associato Yuichi Hiratsuka del JAIST e il Prof. Tomohiko Taguchi della Tohoku University, Giappone.
La loro strategia è incentrata sull'uso di nanoparticelle ibride magnetico-plasmoniche (MPNP) fatte di argento e una lega ferro-cobalto e ricoperte da un composto chiamato amino destrano (aDxt). La base di questo approccio è che gli MPNP ricoperti da aDxt vengono ingeriti naturalmente dalle cellule attraverso "endocitosi", che culmina all'interno dei lisosomi. Una volta che un numero sufficiente di MPNP si è accumulato all'interno dei lisosomi, le cellule possono essere delicatamente "frantumate" e i lisosomi recuperati utilizzando i magneti.
Affinché questo metodo funzioni, è essenziale che gli MPNP si trovino solo all'interno dei lisosomi e non in altri organelli. È qui che l'imaging plasmonico torna utile, poiché il modo distinto in cui le nanoparticelle plasmoniche interagiscono con la luce le rende facili da visualizzare con un microscopio ottico. Colorando ogni tipo di organello nella via endocitica in modo diverso usando l'immunocolorazione e controllando come la posizione degli MPNP si sovrappone ad essi, i ricercatori hanno determinato il tempo preciso impiegato dalla maggior parte degli MPNP per raggiungere i lisosomi. A sua volta, ciò garantisce che il processo di separazione produca campioni di lisosoma con elevata purezza.
Successivamente, il team ha analizzato gli effetti della temperatura e del tempo di separazione magnetica sulla composizione proteica dei lisosomi estratti. I loro risultati hanno mostrato che la perdita di proteine era notevolmente rapida, anche a temperature fino a 4°C. Fortunatamente, il loro approccio è stato abbastanza veloce da estrarre i lisosomi intatti, come sottolinea il Prof. Maenosono:"Abbiamo scoperto che il tempo massimo richiesto per isolare i lisosomi dopo la rottura delle cellule era di 30 minuti, che è sostanzialmente più breve del tempo richiesto utilizzando le tecniche basate sulla centrifugazione, che tipicamente richiedono un tempo minimo di separazione di diverse ore."
Nel complesso, questa nuova tecnica aiuterà i ricercatori a esplorare i fragili metaboliti dei lisosomi e il modo in cui cambiano in risposta agli stimoli. A sua volta, questo aprirà la strada a nuove intuizioni sui disturbi legati alla disfunzione lisosomiale. A questo proposito, il Prof. Maenosono rimarca:"Data la profonda relazione dei lisosomi con molti metaboliti cellulari, è necessaria una comprensione più profonda della funzione lisosomiale per determinarne la regolazione in diversi stati cellulari. Pertanto, la nostra tecnica può contribuire a una migliore comprensione e trattamento di malattie lisosomiali in futuro". Inoltre, questo nuovo approccio potrebbe essere modificato per estrarre altri organelli oltre ai lisosomi. Si spera che questo studio ci avvicini alla comprensione del contenuto delle cellule a un livello molto più elevato. + Esplora ulteriormente