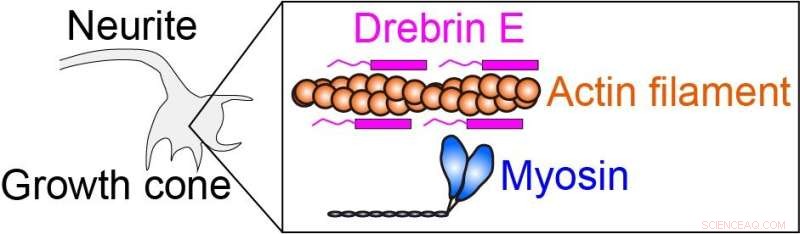
La forza intracellulare è prodotta dalla miosina che interagisce con il filamento di actina (filamento proteico). Drebrina E può inibire l'interazione actina-miosina, quindi regolare la forza intracellulare. È noto che la concentrazione di drebrin E diminuisce durante lo sviluppo animale. Tuttavia, una correlazione tra la concentrazione di drebrin e l'attività actina-miosina è rimasta poco chiara, specialmente alla temperatura fisiologica. Credito:Hiroaki Kubota et al.
Un grado Celsius può fare la differenza:un team di ricercatori guidato dall'Università di Osaka ha dimostrato la regolazione di un complesso proteico critico che si verifica solo a temperatura fisiologica.
Per studiare le funzioni delle proteine, i ricercatori esaminano le proteine purificate in vitro. Tali esperimenti sono generalmente limitati a temperature inferiori alla temperatura fisiologica per prevenire danni termici alle proteine. Il team ha superato questo problema applicando il riscaldamento controllato otticamente con un laser a infrarossi pulsato. "Con questo metodo, le proteine possono essere riscaldate fino a 40 gradi Celsius senza alcun danno alle proteine", afferma l'autore principale Hiroaki Kubota, "che ci consente di esaminare come le proteine agiscono alla loro temperatura fisiologica".
I ricercatori hanno applicato questo metodo di riscaldamento per studiare il complesso di actomiosina. La generazione della forza dell'actomiosina, che risulta dall'interazione tra i motori molecolari della miosina e i filamenti di actina, è un processo cruciale che governa la motilità e la morfologia cellulare. È stato dimostrato che la proteina drebrin E inibisce queste interazioni, ma il suo meccanismo di regolazione non è chiaro. Per chiarire il ruolo della drebrina E, il team ha applicato il riscaldamento microscopico all'actomiosina in presenza di drebrina e ha osservato la motilità prodotta dalla generazione della forza dell'actomiosina in un intervallo dalla temperatura ambiente alla temperatura fisiologica.
I ricercatori hanno scoperto che l'inibizione della motilità dell'actomiosina da parte della drebrin E viene eliminata immediatamente e in modo reversibile durante il riscaldamento, a seconda della concentrazione di drebrin E. All'aumentare della temperatura, l'inibizione della motilità dell'attomiosina da parte della drebrin E diminuisce. Il team ha anche scoperto che la ridotta inibizione non è causata esclusivamente dalla dissociazione della drebrin E dall'actina. Invece, la drebrin E legata regola in modo cooperativo l'attività dell'actomiosina probabilmente alterando la struttura dell'actina.
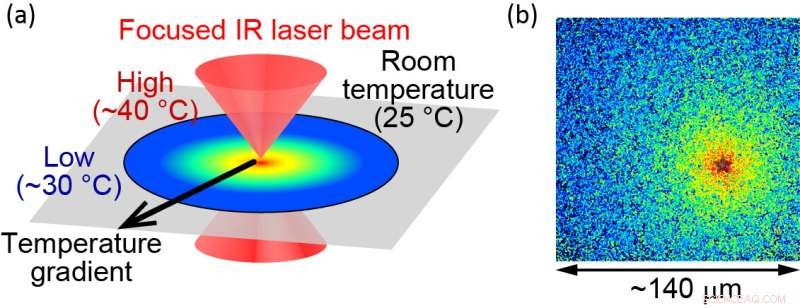
(a) Illustrazione del metodo di riscaldamento microscopico otticamente controllato. (b) La temperatura localizzata viene visualizzata utilizzando molecole fluorescenti. La fonte di calore si trova presso la "stella", dove la temperatura viene misurata a circa 40 °C. La fine del campo visivo è di circa 30 °C. La dimensione del campo visivo è di circa 140 μm. Credito:Hiroaki Kubota et al.
È interessante notare che, al di sotto della temperatura fisiologica, la motilità dell'attomiosina mostra un decadimento graduale con l'aumento della concentrazione di drebrina E. Tuttavia, da 36,5 gradi Celsius a 37,5 gradi Celsius, il comportamento cambia e la drebrin E mostra un comportamento di inibizione di tipo interruttore. La motilità non è influenzata dalla concentrazione di drebrin E fino al raggiungimento di una soglia, che si traduce immediatamente in un'inibizione. I loro risultati suggeriscono che la concentrazione soglia è simile alle concentrazioni fisiologiche di drebrin E precedentemente riportate.
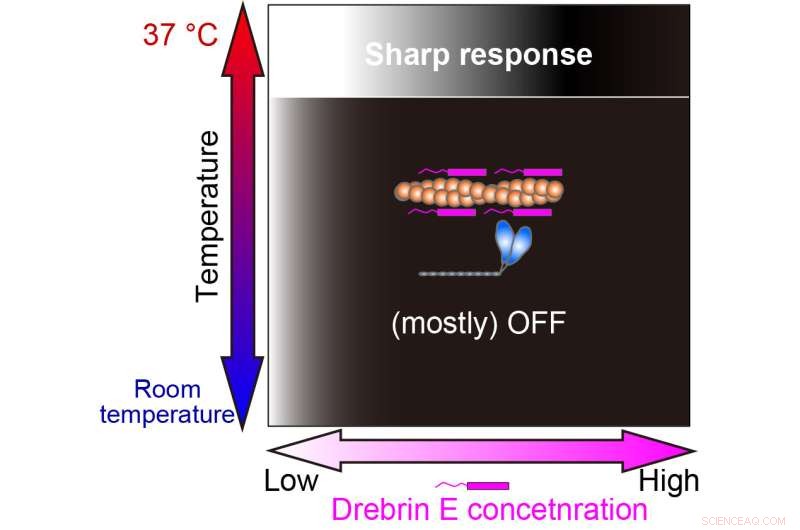
Il nostro studio ha rivelato che la regolazione dell'interazione actina-miosina da parte della drebrin E è efficace solo alla temperatura fisiologica (37°C). La gradazione bianco-nero rappresenta la produzione di forza On (bianco) e Off (nero). Credito:Hiroaki Kubota et al.
Questa regolazione dipendente dalla temperatura della drebrin E è notevole e ha molte implicazioni per studi futuri. "Questi risultati suggeriscono l'importanza per i mammiferi gravidi di mantenere la temperatura corporea appropriata per garantire lo sviluppo preciso di un embrione", afferma Madoka Suzuki, autore senior. Inoltre, acquisendo una comprensione precisa dei meccanismi dei macchinari di rilevamento della temperatura cellulare, potremmo essere in grado di innovare lo sviluppo di sensori di temperatura artificiali su scala nanometrica.
L'articolo, "Il controllo microscopico della temperatura rivela la regolazione cooperativa dell'interazione actina-miosina di drebrin E" è stato pubblicato in Nano Letters . + Esplora ulteriormente