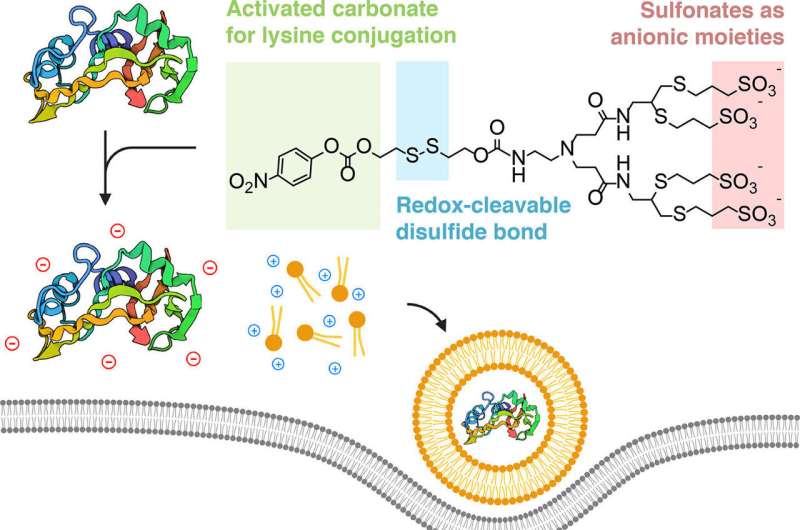
Una collaborazione interdisciplinare ha progettato un modo per "mascherare" le proteine in modo che possano essere catturate da nanoparticelle lipidiche, che sono simili a minuscole bolle di grasso. Queste bolle sono abbastanza piccole da insinuare il loro carico nascosto nelle cellule viventi, dove le proteine si svelano ed esercitano il loro effetto terapeutico.
La tecnica generalizzabile potrebbe portare a riutilizzare migliaia di prodotti proteici commerciali, compresi gli anticorpi, per la ricerca biologica e le applicazioni terapeutiche.
L'articolo del gruppo, "Bioreversible Anionic Cloaking Enables Intracellular Protein Delivery with Ionizable Lipid Nanoparticles", è stato pubblicato il 14 maggio su ACS Central Science . L'autore principale è il dottorando Azmain Alamgir, che lavora nei laboratori dei co-autori senior dell'articolo, Chris Alabi, professore associato di ingegneria chimica e biomolecolare alla Cornell Engineering, e Matt DeLisa, professore di ingegneria e direttore di William L. Lewis del Cornell Institute of Biotechnology.
Il progetto è iniziato con un obiettivo singolare:combinare l'esperienza del gruppo DeLisa nella progettazione di terapie a base di proteine con l'attenzione del laboratorio Alabi sulla somministrazione intracellulare di prodotti biologici.
Affinché alcuni farmaci possano avere un impatto sulla biologia di una cellula e, in definitiva, curare la malattia, devono entrare nella cellula e raggiungere uno spazio specifico. È simile alla riparazione di un tubo rotto in una casa:l'idraulico deve accedere a una stanza particolare per riparare la perdita.
Le terapie a base proteica hanno molte virtù – possono avere effetti più specifici, con minore tossicità e ridotta risposta immunitaria – ma la facilità di somministrazione non è una di queste. Le proteine sono grandi e ingombranti e non si diffondono liberamente nelle cellule con la stessa facilità con cui lo fanno le piccole molecole. Questo è uno dei motivi per cui le piccole molecole sono la fonte predominante di farmaci nell'industria farmaceutica:possono facilmente diffondersi nelle cellule senza un veicolo di trasporto.
Nel corso degli anni, il gruppo di DeLisa ha sviluppato un'ampia gamma di candidati farmaci proteici interessanti e potenzialmente efficaci. Sfortunatamente, l’utilità pratica di queste proteine è stata limitata dall’assenza di un metodo per il rilascio intracellulare. Sebbene la terapia genica, una tecnologia biomedica in grado di produrre un effetto terapeutico fornendo un gene per l'espressione nelle cellule bersaglio, fosse un'opzione, il metodo ha una storia movimentata, a causa di problemi di sicurezza negli esseri umani.
"Stavamo cercando un modo intelligente per portare in modo efficiente le nostre proteine ingegnerizzate all'interno delle cellule, soprattutto in un contesto traslazionale che non solo funzionasse nelle cellule coltivate in laboratorio, ma che fosse anche efficace e sicuro nei modelli animali e infine negli esseri umani". ," ha detto DeLisa.
"Quando Azmain ha collegato il nostro gruppo con il gruppo di Chris, una delle idee emerse è stata:perché fornirla come terapia genetica quando potevamo fornirla come proteina già prodotta? E questo ci ha davvero entusiasmati."
Il laboratorio di Alabi aveva dovuto affrontare sfide proprie. Sebbene il team avesse esperienza nel fornire acidi nucleici nelle cellule utilizzando nanoparticelle, ha detto Alabi, dovevano ancora trovare un modo per fare lo stesso con "proteine morbide e morbide globulari" a causa della limitata esperienza del laboratorio nella produzione di quantità sufficienti di proteine per i test.
"Lo abbiamo visto come un bel ponte tra i nostri gruppi di ricerca, per creare questo nuovo spazio su cui non credo che molte persone stessero lavorando in quel momento e farlo in un modo che potesse essere scalabile e di grande impatto", ha detto Alabi .
I ricercatori hanno avuto l’idea generale di utilizzare un approccio di bioconiugazione che consentirebbe di caricare le proteine in nanoparticelle lipidiche, che si formano attorno agli acidi nucleici. Uno dei principali vantaggi di questo approccio è stato il fatto che le nanoparticelle lipidiche erano un componente chiave dei vaccini anti-COVID-19 sviluppati da Pfizer-BioNTech e Moderna.
"All'epoca, quella tecnologia stava davvero decollando", ha detto Alamgir.
Quei vaccini funzionavano fornendo un carico utile sotto forma di RNA messaggero, che sono acidi nucleici. I ricercatori ora utilizzerebbero lo stesso concetto di rilascio di nanoparticelle lipidiche – anche gli stessi materiali – ma con un carico utile di proteine. Il trucco sarebbe rendere le proteine più simili agli acidi nucleici.
I ricercatori hanno scoperto che potevano ottenere questo risultato "ricoprendo" le proteine con uno ione caricato negativamente, in modo che si unissero elettrostaticamente ai lipidi caricati positivamente.
"Il punto cruciale della nostra strategia è concettualmente molto semplice", ha detto Alamgir. "Stiamo prendendo proteine e rimodellando in modo specifico le loro superfici con cariche negative, in modo che assomiglino ad acidi nucleici e possano assemblarsi in modo simile in nanoparticelle quando formulate con i lipidi caratteristici."
Una difficoltà incontrata dal team è stata che le condizioni in cui gli acidi nucleici sono formulati per unirsi o complessarsi con i lipidi sono piuttosto difficili, troppo difficili per le proteine.
"Abbiamo dovuto utilizzare condizioni più blande e una formulazione leggermente modificata in cui abbiamo aggiunto lipidi extra", ha affermato Alabi. "Quindi, sia dal punto di vista della bioconiugazione delle proteine, sia da quello dei lipidi, abbiamo dovuto modificare la formulazione per far sì che funzionasse bene."
Il team, che comprendeva il dottorando e coautore Souvik Ghosal, ha dimostrato con successo il metodo di mascheramento con composti solfonati reattivi alla lisina, uccidendo le cellule tumorali con la ribonucleasi A e inibendo la segnalazione del tumore con anticorpi monoclonali di immunoglobulina G (IgG).
Un ulteriore vantaggio della chimica della bioconiugazione utilizzata dal team è che il processo è reversibile. L'etichetta chimica aggiunta alla proteina si stacca una volta entrata nel citoplasma della cellula. E poiché il metodo di bioconiugazione prende di mira la lisina, un tipo di amminoacido abbondantemente presente nelle proteine naturali, la tecnica può essere replicata praticamente per qualsiasi proteina.
"Ciò ha il potenziale per prendere molte proteine standard attualmente disponibili presso molti distributori di scienze della vita e aziende di biotecnologia e riutilizzarle per nuove applicazioni intracellulari", ha affermato Alamgir.
Ulteriori informazioni: Azmain Alamgir et al, Il cloaking anionico bioreversibile consente il rilascio di proteine intracellulari con nanoparticelle lipidiche ionizzabili, ACS Central Science (2024). DOI:10.1021/acscentsci.4c00071
Informazioni sul giornale: ACS Scienza Centrale
Fornito dalla Cornell University