
I ricercatori spesso studiano biomolecole come proteine o amminoacidi collegando chimicamente un "fluoroforo", una molecola sensibile che assorbe e riemette energia dalla luce.
Quando attivati da un laser e fotografati attraverso un microscopio ad alta potenza, questi tag o etichette fluoroforali esplodono in un arcobaleno di colori e informazioni. Forniscono una vasta gamma di informazioni che possono, ad esempio, aiutare a rilevare malattie o identificare condizioni genetiche.
Per rilevare più di un tipo di molecola alla volta, o misurazioni "multiplex", vengono utilizzati ulteriori tipi di fluorofori che emettono diversi colori di luce. Ma è sorprendentemente difficile distinguere i diversi colori a livello di singola molecola. Questo è il motivo per cui la maggior parte dei microscopi osserva solo tre o quattro colori.
I ricercatori possono rompere questa barriera cromatica utilizzando tecniche avanzate che comportano cicli di etichettatura e imaging di giorni interi o impiegando configurazioni complicate con molti laser. Trovare un modo semplice e veloce per vedere molti colori, tuttavia, è rimasta una sfida importante.
I ricercatori della Pritzker School of Molecular Engineering dell'Università di Chicago hanno trovato una nuova soluzione a questa sfida, delineata in un articolo pubblicato oggi su Nature Nanotechnology . Una nuova tecnica delineata dallo Squires Lab utilizza tre semplici elementi chimici per progettare dozzine di tag "FRETfluor", creando uno spettro di colori più bello e sfumato che i ricercatori possono utilizzare per etichettare le biomolecole.
"Il nostro approccio è più semplice. Si tratta di un'operazione di etichettatura, di un'operazione di imaging", ha affermato il co-primo autore Jiachong Chu, Ph.D. in ingegneria molecolare Pritzker dell'Università di Chicago. candidato. "Ciò significa che puoi fare di più con meno. Attualmente, la nostra nuova tecnica è la migliore sul campo."
Le singole molecole sono piccole e i campioni cellulari sono relativamente enormi, complicati e disordinati. L'obiettivo finale di quest'area di ricerca, che il documento del team PME ha avvicinato più che mai, è il multiplexing.
"Multiplexare i campioni significa essere in grado, nella stessa misurazione, di misurare più di una specie di molecola, quindi forse si hanno 10 o 50 o centinaia di proteine diverse che si desidera identificare", ha affermato Allison, professore assistente di ingegneria molecolare della famiglia Neubauer. Scudieri. "Con questa nuova tecnica possiamo realizzarne decine. Credo che potremo estenderlo a centinaia."
Per affrontare questa sfida, il team di Squires Lab ha trovato un nuovo modo innovativo di utilizzare una tecnica consolidata:Förster Resonance Energy Transfer o FRET. FRET è un meccanismo che descrive come l'energia viene trasferita tra molecole sensibili alla luce. È un modo con cui i ricercatori possono misurare la distanza tra le diverse parti di una molecola o segnalare quando due molecole interagiscono. I segnali FRET sono eccezionalmente sensibili alle proprietà dei fluorofori partecipanti, che il team dell'UChicago ha utilizzato per mettere a punto le proprie etichette FRETfluor.
"Questo progetto utilizza FRET in un modo nuovo", ha affermato la co-prima autrice Ayesha Ejaz, Ph.D. candidato in Chimica. "FRET è comunemente utilizzato per misurare le distanze e osservare le dinamiche nelle biomolecole. Abbiamo modificato la spaziatura tra un colorante donatore e un accettore per creare diverse efficienze FRET e altre proprietà che utilizziamo per identificare i diversi costrutti."
I 27 tag utilizzati nella ricerca del team PME erano 27 "FRETfluors" progettati utilizzando una semplice combinazione di DNA, un colorante cianinico verde (Cy3) e un colorante cianinico rosso (Cy5). Oltre a brillare in diversi colori, i FRETfluor mostrano ciascuno altre proprietà sintonizzabili come i tempi di come vengono emessi i fotoni o quali sono gli orientamenti di questi fotoni.
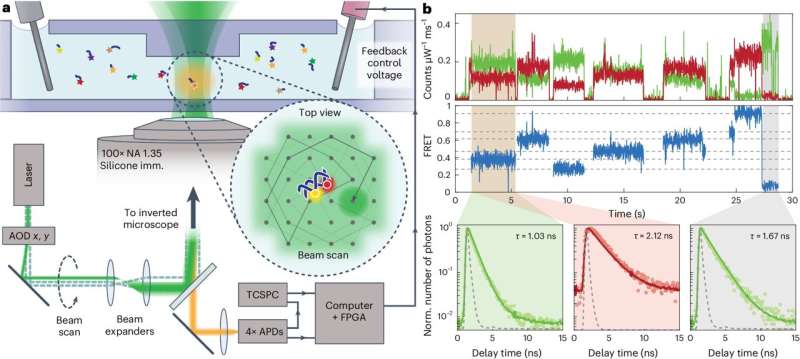
Insieme, queste proprietà possono essere utilizzate per identificare un FRETfluor in appena una frazione di secondo, a concentrazioni ultra-basse. Ejaz ha affermato che una possibile direzione futura per questa ricerca è quella di sostituire eventualmente i normali tag fluoroforici con questi FRETfluor.
"Di solito, quando le persone vogliono osservare più cose, come le diverse parti di una cellula, contemporaneamente, etichettano ciascun componente con un tag fluorescente diverso che emette un certo colore di luce. Ma i tag fluorescenti sono limitati a quattro o cinque colori ," ha detto Ejaz.
"Se invece si potesse utilizzare FRETfluors, allora potremmo aumentare il numero di "colori" disponibili per la microscopia a fluorescenza. Attualmente stiamo testando il funzionamento dei FRETfluors in diversi tipi di esperimenti e ambienti che ci daranno una migliore comprensione di tutti le possibilità."
"Sono entusiasta di vedere i FRETfluor in azione", ha affermato.
Per Squires, gran parte del fascino della nuova tecnica multiplexing deriva dalla sensibilità combinata con la semplicità.
"Tutti vogliono eseguire il multiplex del proprio test preferito e esistono molte strategie che funzionano in determinate situazioni", ha affermato. "Esistono tecniche che funzionano bene quando hai tantissimo tempo o quando il campione è morto e quindi non si muove nulla.
"Stiamo affrontando il problema in cui non hai molto tempo. Vuoi sapere quale malattia ha qualcuno mentre c'è ancora tempo per combatterla, oppure hai solo un piccolissimo campione e hai una possibilità per identificare ogni molecola mentre scorre attraverso il tuo canale. Possiamo identificare i FRETfluors in una frazione di secondo fino a decine di concentrazioni femtomolari."
La semplicità è fondamentale, sia utilizzando sostanze chimiche comuni per produrre FRETfluor, sia sperimentando una tecnica che richiede solo un laser per la lettura.
"Etichettiamo il target solo una volta ed eseguiamo la lettura solo una volta", ha detto Chu. "In questo contesto, possiamo creare 27 tag diversi che possono essere utilizzati contemporaneamente."
Squires ha descritto come le tecniche esistenti potrebbero essere utilizzate insieme ai FRETfluors per maggiori guadagni di multiplexing ("potresti introdurre schemi fantasiosi di eccitazione laser o incorporare altri fluorofori che hanno proprietà leggermente diverse"), che migliorerebbero le letture dalle etichette esistenti.
L'applicazione di questi moltiplicatori alla loro nuova e più potente tecnica, ha affermato Squires, può aprire mondi di nuove ricerche e applicazioni.
"Questi miglioramenti all'imaging e ai test biomedici basati sul flusso consentiranno la prossima generazione di innovazione", ha affermato Squires.
Ulteriori informazioni: Jiachong Chu et al, Multiplexing di fluorescenza a molecola singola mediante rilevamento spettroscopico multiparametrico di etichette FRET nanostrutturate, Nature Nanotechnology (2024). DOI:10.1038/s41565-024-01672-8
Informazioni sul giornale: Nanotecnologia naturale
Fornito dall'Università di Chicago