Una nuova tecnica di imaging sviluppata dagli ingegneri della Washington University di St. Louis può fornire agli scienziati uno sguardo molto più da vicino sugli insiemi di fibrille, ovvero pile di peptidi che includono l'amiloide-beta, associati in particolare al morbo di Alzheimer.
Questi gruppi di fibrille β incrociate sono anche utili elementi costitutivi all’interno di biomateriali di progettazione per applicazioni mediche, ma la loro somiglianza con i loro cugini beta amiloide, i cui grovigli sono un sintomo di malattia neurodegenerativa, è preoccupante. I ricercatori vogliono scoprire come le diverse sequenze di questi peptidi sono collegate alla loro diversa tossicità e funzione, sia per i peptidi presenti in natura che per i loro cugini ingegnerizzati sinteticamente.
Ora, gli scienziati possono osservare abbastanza da vicino gli assemblaggi di fibrille per vedere che ci sono notevoli differenze nel modo in cui i peptidi sintetici si impilano rispetto all’amiloide-beta. Questi risultati derivano da una fruttuosa collaborazione tra l'autore principale Matthew Lew, professore associato di ingegneria elettrica e dei sistemi, e Jai Rudra, professore associato di ingegneria biomedica, presso la McKelvey School of Engineering di WashU.
"Noi progettiamo microscopi per consentire misurazioni su scala nanometrica migliori in modo che la scienza possa progredire", ha affermato Lew.
In un articolo pubblicato di recente su ACS Nano , Lew e colleghi descrivono come hanno utilizzato la sonda chimica del rosso del Nilo per illuminare le fibrille β incrociate. La loro tecnica, chiamata microscopia di orientamento-localizzazione di singola molecola (SMOLM), utilizza i lampi di luce del rosso Nilo per visualizzare le strutture fibrose formate da peptidi sintetici e beta amiloide.
Il punto è che queste assemblee sono molto più complicate ed eterogenee del previsto. Questa è una buona notizia perché significa che esiste più di un modo per impilare in modo sicuro le proteine. Con misurazioni e immagini migliori degli assemblaggi di fibrille, i bioingegneri possono comprendere meglio le regole che determinano il modo in cui la grammatica proteica influisce sulla tossicità e sulla funzione biologica, portando a terapie più efficaci e meno tossiche.
Innanzitutto, gli scienziati devono vedere la differenza tra loro, qualcosa di molto impegnativo a causa delle dimensioni ridotte di questi gruppi.
"La torsione elicoidale di queste fibre è impossibile da discernere utilizzando un microscopio ottico, o anche alcuni microscopi a super risoluzione, perché queste cose sono semplicemente troppo piccole", ha detto Lew.
Grazie alla tecnologia di imaging ad alta dimensione sviluppata nel laboratorio di Lew negli ultimi due anni, sono in grado di vedere le differenze.
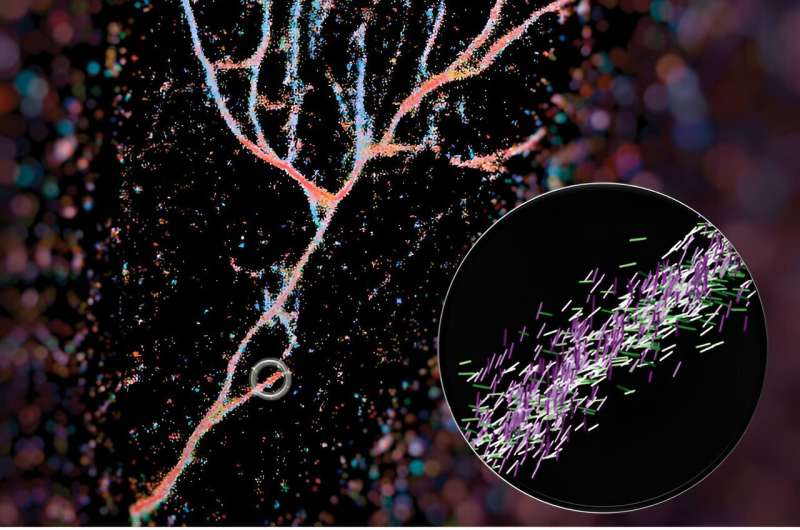
Un tipico microscopio a fluorescenza utilizza molecole fluorescenti come lampadine per evidenziare alcuni aspetti di un bersaglio biologico. Nel caso di questo lavoro, hanno usato una di quelle sonde, Nile Red, come sensore per ciò che c’era intorno. Mentre il Nilo rosso esplora casualmente il suo ambiente e si scontra con le fibrille, emette lampi di luce che possono essere misurati per determinare dove si trova la sonda fluorescente e il suo orientamento. Da questi dati, possono ricostruire il quadro completo delle fibrille ingegnerizzate che si accumulano in modo molto diverso da quelle naturali, come l'amiloide-beta.
La loro immagine di questi gruppi di fibrille è stata utilizzata per la copertina di ACS Nano ed è stato messo insieme dal primo autore Weiyan Zhou, che ha codificato a colori l'immagine in base a dove puntavano i rossi del Nilo. L'immagine risultante è un insieme fluente di peptidi rosso bluastro che assomiglia ad una valle fluviale.
I ricercatori intendono continuare a sviluppare tecniche come SMOLM per aprire nuove strade allo studio delle strutture e dei processi biologici su scala nanometrica.
"Stiamo vedendo cose che non è possibile vedere con la tecnologia esistente", ha affermato Lew.
Ulteriori informazioni: Weiyan Zhou et al, Risoluzione della struttura su scala nanometrica degli autoassemblaggi di peptidi β-sheet utilizzando la microscopia di orientamento-localizzazione di singole molecole, ACS Nano (2024). DOI:10.1021/acsnano.3c11771
Informazioni sul giornale: ACS Nano
Fornito dalla Washington University di St. Louis