I vaccini terapeutici contro il cancro sono una forma di immunoterapia in divenire che potrebbe non solo distruggere le cellule tumorali nei pazienti, ma anche impedire al cancro di ripresentarsi e diffondersi. Numerosi vaccini terapeutici contro il cancro sono oggetto di studi clinici, ma, nonostante le loro promesse, non vengono ancora utilizzati di routine dagli oncologi clinici per curare i loro pazienti.
L'ingrediente centrale dei vaccini terapeutici contro il cancro sono gli antigeni, che vengono prodotti o prodotti ex novo (neoantigeni) dalle cellule tumorali e consentono al sistema immunitario del paziente di cercare e distruggere le cellule cancerose.
Nella maggior parte dei casi, questi antigeni non possono agire da soli e necessitano dell’aiuto di molecole adiuvanti che innescano un segnale di allarme generale nelle cellule immunitarie note come cellule presentanti l’antigene (APC). Le APC interiorizzano sia le molecole antigeniche che quelle adiuvanti e presentano gli antigeni a diversi tipi di cellule T. Queste cellule T lanciano quindi un attacco immediato contro il tumore o preservano una memoria più duratura del tumore per la difesa futura.
L’efficacia di un vaccino contro il cancro dipende dal livello e dalla durata dell’”allarme” che i suoi adiuvanti possono far suonare nelle APC. In precedenza, i ricercatori avevano scoperto che fornire simultaneamente molecole di adiuvante e antigene alle APC utilizzando nanostrutture come gli origami di DNA può aumentare l’attivazione delle APC. Tuttavia, nessuno di questi approcci ha studiato sistematicamente il modo in cui il numero e la disposizione su scala nanometrica delle molecole adiuvanti influenzano l'immunità diretta al tumore a valle.
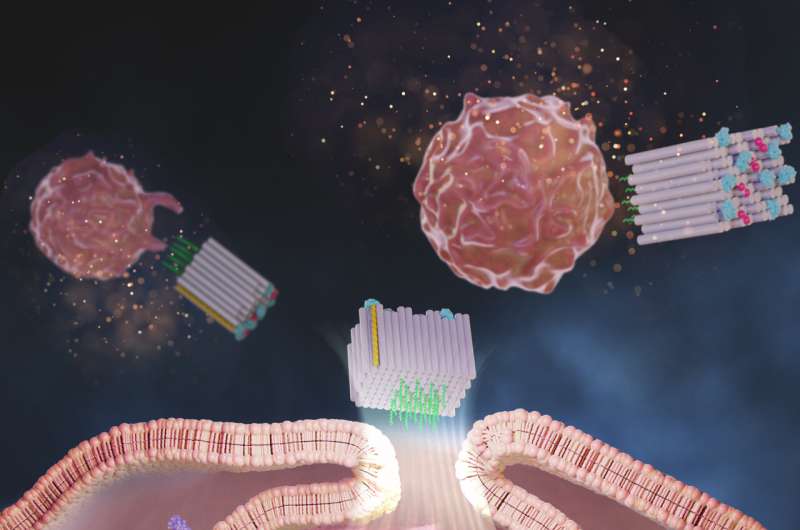
Ora, un gruppo di ricerca del Wyss Institute dell’Università di Harvard, del Dana-Farber Cancer Institute (DFCI), della Harvard Medical School (HMS) e del Korea Institute of Science and Technology (KIST) ha creato una piattaforma di origami di DNA chiamata DoriVac, il cui nucleo Il componente è una nanostruttura autoassemblante a forma di blocco quadrato.
Ad una faccia del blocco quadrato, un numero definito di molecole adiuvanti può essere attaccato in modelli altamente sintonizzabili e nanoprecisi, mentre la faccia opposta può legare gli antigeni tumorali. Lo studio ha scoperto che le molecole di un adiuvante noto come CpG distanziate esattamente di 3,5 nanometri l'una dall'altra hanno prodotto la stimolazione più vantaggiosa delle APC che hanno indotto un profilo altamente desiderabile delle cellule T, comprese quelle che uccidono le cellule tumorali (cellule T citotossiche), quelli che causano un'infiammazione benefica (cellule T polarizzate Th-1) e quelli che forniscono una memoria immunitaria a lungo termine del tumore (cellule T di memoria).
I vaccini DoriVac hanno consentito ai topi portatori di tumore di controllare meglio la crescita dei tumori e di sopravvivere significativamente più a lungo rispetto ai topi di controllo. È importante sottolineare che gli effetti di DoriVac sono anche in sinergia con quelli degli inibitori del checkpoint immunitario, che rappresentano un’immunoterapia di grande successo già ampiamente utilizzata in clinica. I risultati sono pubblicati su Nature Nanotechnology .
"La tecnologia del vaccino origami a DNA di DoriVac unisce diverse capacità nanotecnologiche che abbiamo sviluppato nel corso degli anni con una conoscenza sempre più approfondita dei processi immunitari che sopprimono il cancro", ha affermato William Shih, Ph.D., membro della Wyss Core Faculty, che ha guidato il team del Wyss Institute. insieme al primo autore Yang (Claire) Zeng, M.D., Ph.D..
"Noi immaginiamo che in futuro gli antigeni identificati in pazienti con diversi tipi di tumori possano essere rapidamente caricati su origami di DNA prefabbricati contenenti adiuvanti per consentire vaccini antitumorali personalizzati altamente efficaci che possano essere accoppiati con inibitori del checkpoint approvati dalla FDA in terapie combinate. "
Shih è anche professore presso il Dipartimento di biologia del cancro dell'HMS e del DFCI e, come alcuni degli altri autori, membro del centro interistituzionale "Immunoingegneria per migliorare l'immunoterapia" (i3) con sede al Wyss.
L'adiuvante CpG è un filamento sintetico di DNA costituito da motivi nucleotidici CpG ripetuti che imitano il materiale genetico di agenti patogeni batterici e virali che invadono le cellule immunitarie. Come le sue controparti naturali, gli adiuvanti CpG si legano a un "recettore del pericolo" chiamato TLR9 nelle cellule immunitarie, che a sua volta induce una risposta immunitaria infiammatoria (innata) che funziona di concerto con la risposta immunitaria (adattativa) indotta dall'antigene.
"Sapevamo dal lavoro precedente che per innescare forti risposte infiammatorie, i recettori TLR9 devono dimerizzarsi e aggregarsi in complessi multimerici che si legano a più molecole CpG. Le distanze su scala nanometrica tra i domini di legame CpG in complessi TLR9 efficaci rivelate dall'analisi strutturale rientrano proprio nel gamma di ciò che abbiamo ipotizzato di poter rispecchiare con strutture di origami di DNA che presentano molecole CpG distanziate con precisione," ha spiegato Zeng, che era istruttore di medicina al momento dello studio e ora è uno scienziato senior presso DFCI e Harvard Medical School (HMS).
Oltre a Shih, Zeng è stato guidato nel progetto anche dagli autori senior Ju Hee Ryu, Ph.D., ricercatore principale presso il KIST, e dal membro fondatore della Wyss Core Faculty David Mooney, Ph.D., che è anche professore ad Harvard John A. Paulson School of Engineering and Applied Sciences (SEAS) e uno dei principali ricercatori dell'i3 Center.
Zeng e il team hanno fabbricato vaccini DoriVac in cui diversi numeri di filamenti CpG erano distanziati a 2,5, 3,5, 5 o 7 nanometri l'uno dall'altro su una faccia del blocco quadrato e un antigene modello era attaccato alla faccia opposta. Hanno protetto le loro strutture dalla degradazione nel corpo utilizzando un metodo di modificazione chimica che il gruppo di Shih aveva sviluppato in precedenza.
Quando internalizzati da diversi tipi di APC, comprese le cellule dendritiche (DC), che orchestrano le risposte delle cellule T dirette dal tumore, i vaccini DoriVac hanno migliorato l'assorbimento degli antigeni rispetto ai controlli costituiti da molecole di antigene libere.
Una spaziatura CpG di 3,5 nanometri ha prodotto le risposte più forti e benefiche nelle APC e ha sovraperformato significativamente un vaccino di controllo contenente solo molecole CpG libere.
"Siamo stati entusiasti di scoprire che il vaccino DoriVac ha indotto preferenzialmente uno stato di attivazione immunitaria che supporta l'immunità antitumorale, che è ciò che i ricercatori generalmente vogliono vedere in un buon vaccino", ha affermato Zeng.
Oltre alla spaziatura, contava anche il numero di molecole CpG nei vaccini DoriVac. Il team ha testato vaccini contenenti da 12 a 63 molecole CpG distanziate in modo ottimale e ha scoperto che 18 molecole CpG fornivano la migliore attivazione APC. Ciò significa che il loro approccio può anche contribuire a limitare il dosaggio delle molecole CpG e quindi a ridurre al minimo gli effetti collaterali tossici comunemente osservati con gli adiuvanti.
È importante sottolineare che queste tendenze in vitro si sono tradotte in modelli tumorali murini in vivo. Quando iniettati profilatticamente sotto la pelle dei topi, i vaccini DoriVac si accumulavano nei linfonodi più vicini dove stimolavano le DC.
Un vaccino caricato con un antigene del melanoma ha impedito la crescita di cellule di melanoma aggressive successivamente iniettate. Mentre tutti gli animali di controllo erano morti a causa del cancro entro il 42° giorno dell'esperimento, gli animali protetti da DoriVac erano tutti vivi.
I vaccini DoriVac hanno anche inibito la crescita del tumore nei topi in cui la formazione di tumori del melanoma era già in corso, con una spaziatura di 3,5 nanometri di 18 molecole CpG fornendo nuovamente i massimi effetti sulle cellule DC e T e la più forte riduzione della crescita del tumore.
Successivamente, il team si è chiesto se i vaccini DoriVac potessero anche potenziare le risposte immunitarie prodotte da piccoli "neoantigeni" che emergono nei tumori del melanoma.
I neoantigeni sono bersagli ideali perché sono prodotti esclusivamente da cellule tumorali. Tuttavia, spesso non sono molto immunogenici, il che rende gli adiuvanti altamente efficaci un componente importante nei vaccini neoantigenici. Un vaccino DoriVac personalizzato con quattro neoantigeni ha permesso ai ricercatori di sopprimere in modo significativo la crescita del tumore nei topi che producevano i neoantigeni.
Infine, i ricercatori si sono chiesti se DoriVac potesse creare sinergia con la terapia del checkpoint immunitario, che riattiva le cellule T che sono state silenziate nei tumori.
Nei topi, le due terapie combinate hanno portato alla regressione totale dei tumori del melanoma e hanno impedito loro di ricrescere quando gli animali sono stati nuovamente esposti alle stesse cellule tumorali quattro mesi dopo. Gli animali avevano sviluppato una memoria immunitaria del tumore. Il team ha ottenuto un'efficacia vaccinale simile in un modello di linfoma murino.
"Riteniamo che il valore di DoriVac nel determinare uno sweet spot nella somministrazione di adiuvanti e nel migliorare la somministrazione e gli effetti degli antigeni accoppiati possa aprire la strada a vaccini clinici contro il cancro più efficaci da utilizzare in pazienti con una varietà di tumori", ha affermato Zeng.
Il team sta attualmente traducendo la piattaforma DoriVac verso la sua applicazione clinica, che è supportata dalla valutazione dello studio sulla distribuzione del vaccino e sugli anticorpi diretti al vaccino nei topi, nonché sulle citochine prodotte dalle cellule immunitarie in risposta ai vaccini in vivo.
"La piattaforma DoriVac è il nostro primo esempio di come la nostra ricerca su ciò che chiamiamo Robotica Molecolare - molecole sintetiche bioispirate con forma e funzione programmabili - può portare a terapie completamente nuove e potenti. Questa tecnologia apre un percorso completamente nuovo per lo sviluppo di vaccini progettati con proprietà su misura per affrontare sfide cliniche specifiche. Ci auguriamo di vedere la sua rapida trasposizione nella clinica", ha affermato il direttore fondatore del Wyss Institute, Donald Ingber, M.D., Ph.D.
Ulteriori informazioni: Yang C. Zeng et al, Messa a punto della distribuzione spaziale CpG con origami di DNA per una migliore vaccinazione contro il cancro, Nature Nanotechnology (2024). DOI:10.1038/s41565-024-01615-3
Fornito dall'Università di Harvard