
Le trasfusioni di piastrine sono essenziali nella gestione del sanguinamento e della disfunzione emostatica e possono essere ampliate per essere utilizzate come terapia cellulare per una varietà di malattie. Gli sforzi per creare tali terapie cellulari richiedono che i ricercatori modifichino le piastrine dei donatori per esprimere proteine terapeutiche. Tuttavia, al momento, i metodi appropriati per modificare geneticamente le piastrine raccolte da donatori di sangue rimangono sfuggenti.
In un nuovo studio pubblicato su Science Advances , Jerry Leung e un team di scienziati di nanomedicina, biochimica e biologia molecolare dell'Università della British Columbia, Canada, dell'Università di Hokkaido, Giappone, e varie istituzioni negli Stati Uniti hanno descritto un approccio basato su nanoparticelle lipidiche ottimizzate per le piastrine contenenti mRNA per l'espressione di proteine esogene nelle piastrine umane e di ratto.
Quando il team ha testato la libreria di nanoparticelle mRNA-lipidiche, l'espressione proteica esogena risultante non era correlata all'attivazione piastrinica. Le piastrine trasfettate mantenevano la funzione emostatica e si accumulavano in aree di danno vascolare dopo la trasfusione nei ratti con la capacità di espandere il potenziale terapeutico delle piastrine.
Le piastrine sono parte integrante dell'emostasi e vengono regolarmente trasfuse per ripristinare l'equilibrio emostatico nei pazienti. Queste piastrine possono essere espanse oltre indicazioni come le terapie cellulari per trattare la sepsi, l’infiammazione e l’artrite. Le piastrine geneticamente modificate possono creare nuove terapie cellulari che esprimono proteine terapeutiche, che possono essere implementate per modificare le piastrine dei donatori. I metodi esistenti di elettroporazione, vettori virali e trasfezione commerciale non sono stati in grado di modificare le piastrine dei donatori ed esprimere proteine esogene.
Gli approcci indiretti possono esprimere proteine esogene nelle piastrine o particelle simili alle piastrine prendendo di mira le cellule staminali precursori delle piastrine con vettori lentivirali. Le piastrine derivate dai donatori devono essere modificate funzionalmente per creare autentiche terapie cellulari piastriniche.
Precedenti tentativi di trasfettare piastrine con nanoparticelle lipidiche contenenti mRNA hanno mostrato la possibilità di rilascio di mRNA nelle piastrine, mentre i progressi nella tecnologia delle nanoparticelle lipidiche ne hanno migliorato il potenziale per raggiungere una fascia demografica più ampia.
In questo lavoro, Leung e colleghi hanno segnalato la capacità delle nanoparticelle lipidiche mRNA di trasfettare direttamente le piastrine dei donatori per esprimere proteine esogene. Tali piastrine possono essere modificate con nanoparticelle lipidiche mRNA per mantenere la loro funzione e accumularsi localmente nelle ferite e regolare l'omeostasi dopo la trasfusione nei ratti coagulopatici.
Per identificare i metodi di trasfezione efficaci per le piastrine, il team ha fornito mRNA che codifica un enzima NanoLuc luciferasi (NanoLuc) utilizzando diversi agenti di trasfezione e ne ha misurato l'espressione. Sebbene NanoLuc non sia stato rilevato nelle piastrine trattate con mRNA libero senza un agente di trasfezione o utilizzando agenti di rilascio di mRNA commerciali, il processo ha consentito l'assorbimento di grandi quantità di mRNA nelle piastrine.
Leung e il team hanno rilevato l’espressione di NanoLuc utilizzando una formulazione di nanoparticelle di mRNA-lipidi che somigliavano alla piccola nanoparticella di RNA-lipidi interferente clinicamente testata per il trattamento dell’amiloidosi ereditaria. Il team ha confrontato la quantità di attivazione piastrinica in seguito alla trasfezione delle nanoparticelle lipidiche dell'mRNA con le piastrine non trattate.
Per identificare la formulazione di nanoparticelle mRNA-lipidiche più adatta al trasporto delle piastrine, hanno ottimizzato tre componenti principali; lipidi ionizzabili, lipidi linker e il lipide polietilenglicole. Hanno analizzato 10 lipidi ionizzabili e due lipidi permanentemente cationici e ne hanno misurato l'espressione proteica, l'assorbimento dell'mRNA e l'attivazione per supportare la sintesi proteica.
Azioni delle nanoparticelle lipidiche funzionalizzate in laboratorio
Per esaminare come la combinazione di lipidi ionizzabili e helper abbia effetti sinergici per migliorare l’espressione proteica riducendo al minimo l’attivazione piastrinica, il team ha studiato due lipidi ionizzabili approvati dalla FDA. A parte la loro composizione lipidica, gli elementi dell'mRNA hanno svolto un ruolo significativo nel promuovere un'efficiente sintesi proteica esogena. Le nanoparticelle lipidiche contenenti lipidi helper con una testa di fosfocolina, insieme a lipidi con gruppi di coda ramificati o insaturi, erano più adatte per la trasfezione piastrinica e per determinare livelli di espressione più elevati.
Tra le modifiche dell'RNA testate in questo lavoro, Leung e colleghi hanno notato che l'uridina non modificata, o pseudouridina, facilita livelli di espressione di fluorescenza più elevati. Hanno poi osservato se l'espressione della fluorescenza dipendeva dal grado di attivazione piastrinica o dalla quantità di RNA rilasciato, cosa che hanno studiato utilizzando un'analisi della matrice di correlazione.
Sebbene l’espressione della fluorescenza non fosse fortemente correlata ai livelli piastrinici superficiali o all’assorbimento dell’mRNA, hanno notato una lieve correlazione positiva tra la quantità di RNA erogato e l’attivazione piastrinica. Poiché l'espressione di NanoLuc non era fortemente correlata né ai livelli piastrinici superficiali né all'assorbimento di mRNA, il team ha testato la possibilità di influenzare la sua espressione attivando le piastrine utilizzando agonisti prima e dopo la trasfezione delle nanoparticelle lipidiche dell'mRNA.
Le piastrine stimolate con adenosina difosfato, ad esempio, peptide correlato al collagene reticolato o trombina prima del trattamento con nanoparticelle mRNA-lipidiche, avevano un'espressione di fluorescenza significativamente inferiore. Quando Leung e il team hanno stimolato le piastrine con agonisti per più di due ore, hanno subito un sostanziale riarrangiamento del trascrittoma e del proteoma. I risultati hanno mostrato che la traduzione dell'mRNA esogeno non richiedeva l'attivazione piastrinica.
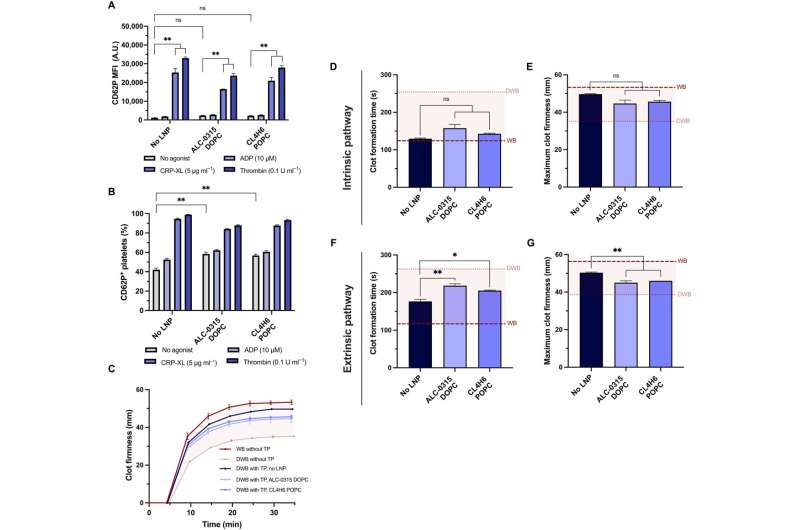
Quando il team ha trattato le piastrine con nanoparticelle lipidiche mRNA, hanno mantenuto la funzione emostatica in vitro e hanno mostrato un'elevata sensibilità ai loro ambienti fisici e chimici. Il team ha studiato se le piastrine potessero ancora essere attivate dopo la trasfezione delle nanoparticelle mRNA-lipidiche e ha misurato il loro stato di attivazione e la risposta agli agonisti fisiologici.
Il team ha testato la capacità delle piastrine trasfettate di mantenere il loro potenziale per contribuire alla compattezza e alla velocità di formazione del coagulo utilizzando un modello di tromboelastometria rotazionale e un modello ex vivo per testare l'attività piastrinica nel sangue intero. I ricercatori hanno modellato la coagulopatia da diluizione utilizzando sangue intero diluito e piastrine preparate in un pacchetto trasfusionale.
Quando hanno combinato il pacchetto trasfusionale con sangue intero diluito per modellare la malattia come si manifesta in un paziente, hanno notato che le nanoparticelle lipidiche non hanno influenzato la coagulopatia piastrinica in vitro. Inoltre, il team ha esplorato l'espressione delle piastrine trasfettate con nanoparticelle lipidiche mRNA espresse con NanoLuc, circolate e localizzate nei siti della ferita dopo la trasfusione in roditori coagulopatici.
In questo modo, Jerry Leung e colleghi hanno mirato alla somministrazione di molecole e terapie cellulari nei siti vascolari di interesse utilizzando le piastrine naturalmente competenti che possono intrinsecamente svolgere questo compito. Il team ha sviluppato nanoparticelle lipidiche e mRNA ottimizzati per le piastrine per un'espressione proteica efficace, presentando al contempo la funzione circolare delle piastrine e l'accumulo locale nel sito vascolare di interesse.
È possibile ottenere il rilascio di acidi nucleici e la traduzione esogena utilizzando nanoparticelle mRNA-lipidiche ottimizzate per le piastrine per ampliare e ingegnerizzare le piastrine per una varietà di applicazioni cliniche. Tali piastrine donatrici progettate con nanoparticelle mRNA-lipidiche possono trattare disturbi emorragici acuti con applicazioni più ampie in oncologia. Queste piastrine trasfuse con nanoparticelle mRNA-lipidiche ottimizzate sono funzionalmente trasfusibili e possono accumularsi nel sito vascolare per terapie piastriniche efficaci per modulare i disturbi ematologici.
Ulteriori informazioni: Jerry Leung et al, Piastrine trasfusibili geneticamente modificate utilizzando nanoparticelle lipidiche mRNA, Progressi scientifici (2023). DOI:10.1126/sciadv.adi0508
Informazioni sul giornale: La scienza avanza
© 2023 Rete Scienza X