Recentemente, il team formato dall'accademico Huang Wei, dal professor Li Lin e dal professor Hu Wen Bo della School of Northwestern Polytechnical University ha sviluppato un agente fototermico NIR-II ultra efficiente per il trattamento fototermico dell'osteosarcoma mediato da laser da 1.064 nm.
Lo studio, "Acceptor Engineering Produces Ultrafast Nonradiative Decay in NIR-II Aza-BODIPY Nanoparticles for Efficient use. Osteosarcoma Photothermal Therapy via Concurrent Apoptosis and Pyroptosis", è stato pubblicato su Research .
Il trattamento del cancro è ancora una delle maggiori sfide che le persone devono affrontare oggi, nonostante la tecnologia medica sostanzialmente migliore. Negli ultimi anni, lo sviluppo di agenti fototermici (PAT) nel vicino infrarosso (NIR), farmaci a bersaglio molecolare per la terapia fototermica (PTT), è emerso come un nuovo punto focale della ricerca.
Rispetto ad altre bande di luce, la luce NIR ha una migliore capacità di penetrazione biologica e può essere utilizzata per un PTT lieve dei tessuti profondi se combinata con PAT appropriati. La maggior parte degli esperimenti sui modelli murini sono ancora nella fase di terapia del tumore sottocutaneo, che è limitata dalla profondità di penetrazione ridotta della luce NIR-I e non può rimuovere il tessuto tumorale profondo nel corpo.
Tuttavia, la profondità di penetrazione della luce NIR-II aumenta e si prevede che il PTT tumorale profondo raggiunga l'applicazione clinica. Al momento, ci sono molti studi sui PTA e vengono spesso sviluppati vari nuovi materiali. I fattori che influenzano la funzione dei PTA includono la lunghezza d'onda di assorbimento, le dimensioni e la modificazione della superficie.
Sebbene diversi tipi di PTA mostrino vantaggi unici, è necessario esplorare un materiale fototermico che integri molti vantaggi come elevate efficienze di conversione fototermica (PCE), una lunga lunghezza d'onda di assorbimento, una forte biosicurezza e una buona solubilità in acqua.
I PTA a piccole molecole con intenso assorbimento NIR-II e PCE elevati sono candidati promettenti per il trattamento di tumori profondi come l'osteosarcoma. Fino ad oggi, lo sviluppo di PTA NIR-II a piccole molecole si è basato in gran parte sulla fabbricazione di strutture donatore-accettore-donatore (D–A–D/D') e i successi ottenuti sono stati limitati.
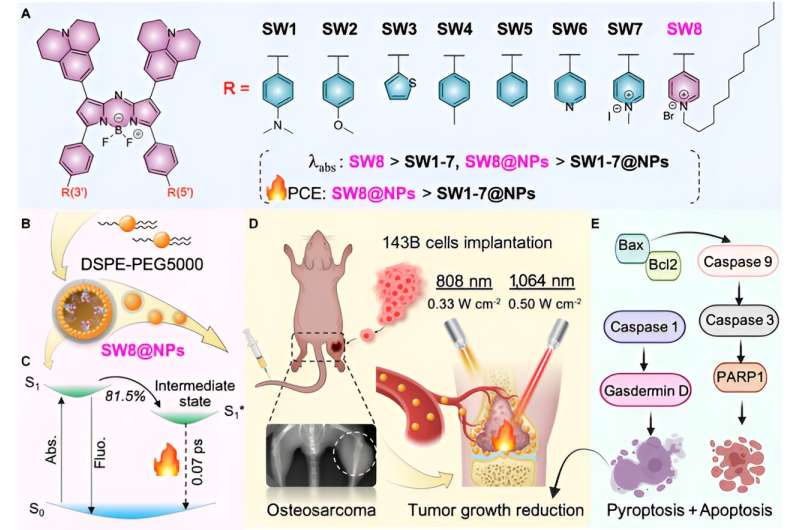
In questo contesto, attraverso l'ingegneria dell'accettore, è stato prontamente sviluppato un PTA (SW8) NIR-II strutturato donatore-accettore-accettore (D–A–A') aza-boro-dipirrometene (aza-BODIPY) per la fototerapeutica mediata da laser da 1.064 nm trattamento dell'osteosarcoma.
Il cambiamento dei gruppi donatori in gruppi accettori ha prodotto notevoli spostamenti verso il rosso dei massimi di assorbimento dalle regioni NIR-I (~ 808 nm) a quelle NIR-II (~ 1.064 nm) per aza-BODIPY (da SW1 a SW8). Inoltre, SW8 si è autoassemblato in nanoparticelle (SW8@NPs) con intenso assorbimento NIR-II e un PCE ultraelevato (75%, 1.064 nm).
Questo PCE ultraelevato ha avuto origine principalmente da un ulteriore percorso di decadimento non radiativo, che ha mostrato un tasso di decadimento potenziato di 100 volte rispetto a quello mostrato dai percorsi convenzionali come la conversione interna e il rilassamento vibrazionale. Alla fine, gli SW8@NP hanno eseguito un PTT NIR-II dell'osteosarcoma mediato da laser da 1.064 nm altamente efficiente tramite apoptosi e piroptosi simultanee.
Questo lavoro non solo illustra un approccio remoto per il trattamento di tumori profondi con elevato controllo spaziotemporale, ma fornisce anche una nuova strategia per costruire PTA NIR-II a piccole molecole ad alte prestazioni.
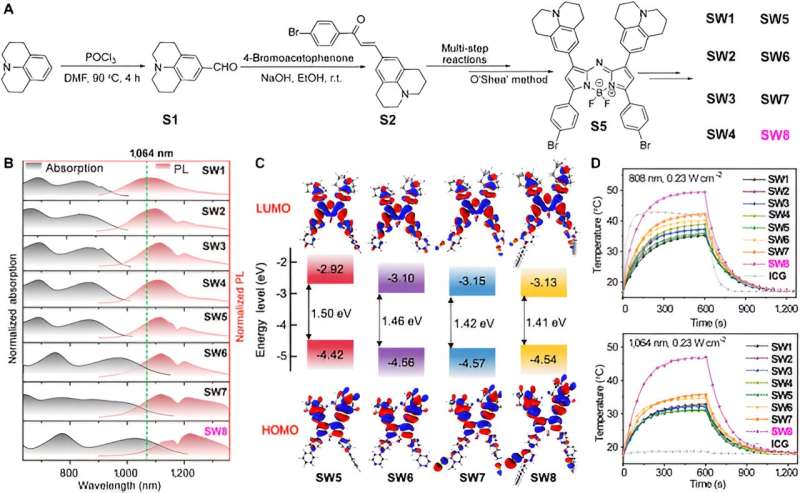
Innanzitutto, i ricercatori hanno sintetizzato una serie di PTA organici a base di piccole molecole aza-BODIPY. In particolare, si sono verificati notevoli spostamenti verso il rosso per l'assorbimento e gli spettri PL da SW5 a SW6, dove il donatore di benzene donatore di elettroni (D') è stato cambiato nell'accettore di piridina (A').
Un ulteriore aumento della carenza di elettroni di A' ha causato più lunghezze d'onda batocromiche da SW6 a SW8, in particolare lo spostamento verso il rosso della lunghezza d'onda di assorbimento è evidente, mentre la porzione donatrice di elettroni (da SW1 a SW5) non ha mostrato alcuno spostamento pronunciato della lunghezza d'onda. Inoltre, l'introduzione delle catene alchiliche ha migliorato l'aggregazione J delle molecole, che si manifesta con uno spostamento verso il rosso della lunghezza d'onda di emissione da SW6 a SW8. I calcoli della teoria del funzionale della densità dipendente dal tempo (TD-DFT) hanno rivelato una diminuzione graduale del gap energetico HOMO-LUMO da SW5 a SW8, coerente con gli spettri spostati verso il rosso.
In particolare, i livelli di energia LUMO per SW5–8 si sono ridotti in ordine, mentre i livelli di energia HOMO sono rimasti quasi invariati. Questo fenomeno indica che i segmenti accettori nelle posizioni 3 e 5 di aza-BODIPY hanno ridotto significativamente i gap energetici, offrendo un approccio alternativo per costruire nuovi materiali NIR-II organici a piccole molecole.
Quindi questo articolo seleziona la lunghezza d'onda di assorbimento/emissione SW8 più vantaggiosa per l'autoassemblaggio. SW8 è stato incapsulato in una matrice anfifila per formare nanoparticelle idrosolubili (SW8@NPs). È stato determinato che il PCE degli SW8@NP sotto irradiazione laser da 1.064 nm raggiunge il 75%, il che rappresenta un notevole miglioramento rispetto a quelli degli SW1-7@NP.
Inoltre, studi spettroscopici ultraveloci hanno attribuito questo PCE ultraelevato a uno stato intermedio non radiativo. Questo intermedio scuro ha impoverito fino all'80% della popolazione eccitata con un tasso di decadimento elevato di 1,3 × 10 13 s -1 rispetto ai canali di decadimento convenzionali non radiativi come la conversione interna, con conseguente PCE ultraelevato.
Infine, per studiare la biocompatibilità degli SW8@NP, la cellula 143B dell'osteosarcoma è stata trattata con SW8@NP. I risultati hanno mostrato che gli SW8@NP potrebbero essere assorbiti in modo efficiente dalle cellule 143B con bassa tossicità al buio ed elevata fototossicità. Il livello di apoptosi è aumentato significativamente dopo 808 nm e sono state scattate 1.064 immagini fototermiche. L'imaging a raggi X è stato utilizzato per monitorare la crescita del tumore ortotopico. i tumori sono stati irradiati con laser per 10 minuti e ripetuti a giorni alterni per 12 giorni.
La curva di tendenza del volume per il gruppo “SW8@NPs +1.064 nm laser” ha dimostrato la completa eradicazione del tumore durante i 12 giorni di monitoraggio. Al contrario, gli altri cinque trattamenti non sono riusciti a sopprimere la crescita del tumore, con un aumento medio del volume del tumore pari a 4-5 volte l’irradiazione laser. Rispetto al laser da 808 nm, il laser da 1.064 nn può penetrare nel tessuto muscolare spesso 15 mm, stimolando efficacemente la produzione di calore di SW8@NP. Ulteriori studi su topi ortotopici portatori di tumore 143B hanno mostrato che gli SW8@NP avevano un elevato accumulo e un forte effetto fototermico nel sito del tumore. Irradiazione continua delle regioni tumorali per 10 minuti utilizzando un 808 (0,33 W cm -2 ) o laser da 1.064 nm (0,5 W cm -2 ) è stato eseguito 24 ore dopo l'iniezione di SW8@NPs.
Inoltre, l'istologia e i test immunoistochimici hanno mostrato che la struttura del tumore nel gruppo "SW8@NPs+1.064 nm" era gravemente danneggiata e le cellule parenchimali erano scomparse in gran numero e apparivano vacuolari, e i risultati TUNEL hanno mostrato che il livello di apoptosi era significativamente è aumentato. Il Western blotting è stato utilizzato per analizzare le proteine associate all'apoptosi (Bax, Bcl2, Caspase 9, Caspase 3 e PARP1).
Nel gruppo "SW8@NPs+1.064 nm", il livello complessivo di fosforilazione della proteina apoptotica è aumentato e l'apoptosi è stata attivata dall'irradiazione. Insieme, i risultati hanno rivelato, per la prima volta, che il PTT NIR-II mediato da SW8@NPs esercitava effetti antitumorali principalmente stimolando l'apoptosi e la piroptosi simultanee.
In questo studio, hanno riferito della progettazione di un nuovo PTA organico a piccole molecole (SW8) e di nanoparticelle autoaccessibili (SW8@NPs) con un PCE elevato (75%) nella finestra NIR-II (1.064 nm). L'analisi della dinamica molecolare dello stato eccitato ha mostrato che questo PCE ultraelevato ha avuto origine principalmente da un ulteriore percorso di decadimento non radiativo.
Una serie di esperimenti in vitro e in vivo ha dimostrato per la prima volta che un PTT NIR-II superiore potrebbe effettivamente indurre apoptosi e piroptosi simultanee nei tessuti dell'osteosarcoma. I ricercatori suggeriscono che la progettazione di PTA organici a piccole molecole basati su principi razionali nella finestra NIR-II andrà a beneficio delle applicazioni cliniche pratiche delle attivazioni e dei trattamenti fototermici in futuro.
Ulteriori informazioni: Zhenxiong Shi et al, Acceptor Engineering produce un decadimento non radiativo ultraveloce in nanoparticelle Aza-BODIPY NIR-II per un'efficiente terapia fototermica dell'osteosarcoma tramite apoptosi e piroptosi simultanee, Ricerca (2023). DOI:10.34133/ricerca.0169
Informazioni sul giornale: Ricerca
Fornito dalla ricerca