Un nuovo modo di vedere dettagli più piccoli della metà della lunghezza d’onda della luce ha rivelato come l’impalcatura su scala nanometrica all’interno delle cellule si collega alla macroscala durante la divisione cellulare. A differenza delle precedenti tecniche di superrisoluzione, quella sviluppata e testata presso l'Università del Michigan non si basa su molecole che si usurano con l'uso prolungato.
La superrisoluzione può rivelare strutture fino a 10 nanometri, o circa la stessa larghezza di 100 atomi. Ha aperto un mondo completamente nuovo nel campo della biologia e le tecniche che per prime lo hanno reso possibile hanno ricevuto un premio Nobel nel 2014. Tuttavia, il suo punto debole è che può scattare istantanee solo in decine di secondi. Ciò rende impossibile osservare l'evoluzione del meccanismo di una cellula per lunghi periodi di tempo.
"Ci chiedevamo:quando il sistema nel suo insieme si divide, come interagiscono le strutture su scala nanometrica con le loro vicine su scala nanometrica, e come si estende questa interazione all'intera cellula?" ha chiesto Somin Lee, assistente professore di ingegneria elettrica e informatica della UM, che ha condotto lo studio pubblicato su Nature Communications .
Per rispondere a questa domanda, Lee e colleghi avevano bisogno di un nuovo tipo di superrisoluzione. Utilizzando il loro nuovo metodo, sono stati in grado di monitorare continuamente una cella per 250 ore.
"La cellula vivente è un luogo affollato con proteine che si muovono qua e là. La nostra superrisoluzione è molto interessante per osservare queste attività dinamiche", ha affermato Guangjie Cui, Ph.D. studente di ingegneria elettrica e informatica e co-primo autore dello studio con Yunbo Liu, un Ph.D. laureato in ingegneria elettrica e informatica.
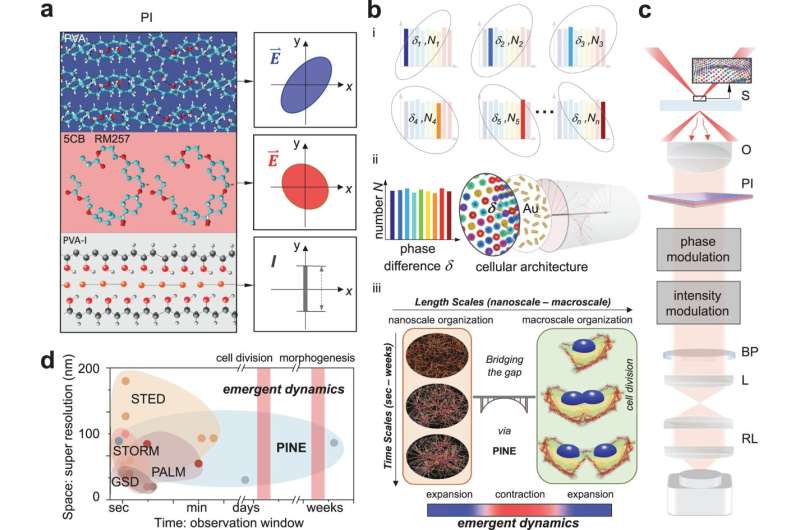
Come il metodo originale, la nuova tecnica utilizza sonde vicino agli oggetti di interesse su scala nanometrica per farne luce. A questo scopo la Super-risoluzione 1.0 utilizzava fluorofori, molecole fluorescenti che emettevano una luce di risposta dopo essere state illuminate. Se i fluorofori fossero più vicini tra loro rispetto alle dimensioni di ciò che viene ripreso, l'immagine potrebbe essere ricostruita dalle esplosioni di luce prodotte dai fluorofori.
La nuova tecnica utilizza nanotubi d'oro, che non si rompono con l'esposizione ripetuta alla luce, ma sfruttare la luce che interagisce con essi è più impegnativo. I nanorodi rispondono alla fase della luce, ovvero al punto in cui si trova nell'oscillazione su e giù dei campi elettrici e magnetici che la compongono. Questa interazione dipende dall'angolazione del nanorod rispetto alla luce in entrata.
Come i fluorofori, i nanotubi possono attaccarsi a particolari strutture cellulari con molecole mirate sulle loro superfici. In questo caso, i nanotubi hanno cercato l’actina, una proteina che aggiunge struttura alle cellule molli. L'actina ha la forma di filamenti ramificati, ciascuno di circa 7 nanometri (milionesimi di millimetro) di diametro, sebbene si colleghino insieme per estendersi per migliaia di nanometri. Anche se i nanotubi hanno spesso più del doppio del diametro dell'actina, i dati che forniscono come gruppo possono illuminarne i minuscoli dettagli.
Per individuare i nanotubi, il team ha costruito filtri costituiti da sottili strati di polimeri e cristalli liquidi. Questi filtri hanno consentito di rilevare la luce con una fase particolare, consentendo al team di individuare nanotubi con angoli particolari rispetto alla luce in entrata. Prendendo 10-30 immagini, ciascuna guardando un diverso sottoinsieme di nanobadi, e unendole in un'unica immagine, il team è stato in grado di dedurre i dettagli su scala nanometrica dei filamenti all'interno delle cellule. Questi dettagli verrebbero offuscati nei microscopi convenzionali.
Utilizzando la tecnica, il team ha scoperto tre regole che governano il modo in cui l'actina si auto-organizza durante la divisione cellulare:
Il comportamento dell'actina è collegato al comportamento della cellula, ma la cellula si contrae quando l'actina si espande e si espande quando l'actina si contrae. Il team vuole esplorare ulteriormente questo aspetto, scoprendo perché i movimenti sono opposti su scale diverse. Vogliono anche studiare le conseguenze della disregolazione di questo processo molecolare:è questo alla radice di alcune malattie?
Più in generale, sperano di utilizzare la superrisoluzione per comprendere come l'autorganizzazione è incorporata nelle strutture biologiche, senza la necessità di un controllo centrale.
"Il nostro codice genetico in realtà non include informazioni sufficienti per codificare ogni dettaglio del processo organizzativo", ha detto Lee. "Vogliamo esplorare i meccanismi dei comportamenti collettivi senza coordinamento centrale che sono come uccelli che volano in formazione, in cui il sistema è guidato dalle interazioni tra le singole parti."
Ulteriori informazioni: Guangjie Cui et al, Il nanoscopio a intensità di fase (PINE) apre finestre di indagine a lungo termine sulla materia vivente, Nature Communications (2023). DOI:10.1038/s41467-023-39624-w
Informazioni sul giornale: Comunicazioni sulla natura
Fornito dall'Università del Michigan