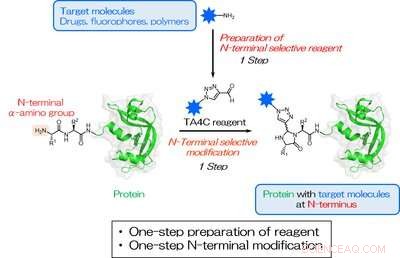
Fig. 1. Una preparazione in un unico passaggio di TA4C e una bioconiugazione in un unico passaggio mirata a un gruppo amminico N-terminale. La stella blu rappresenta una molecola bersaglio per la modifica dell'N-terminale. Credito:Università di Osaka
Le proteine sono ampiamente utilizzate in medicina, biologia e chimica. Migliorare le loro proprietà intrinseche aggiungendo molecole funzionali alle loro strutture è un passo comune e importante in molti campi. Per esempio, l'aggiunta di molecole fluorescenti consente di tracciare e quantificare le proteine. Sono state descritte molte strategie di modifica con vari vantaggi. I ricercatori dell'Università di Osaka ora segnalano una semplice modifica specifica del capolinea N eseguita in condizioni blande utilizzando nuovi reagenti preparati in un unico passaggio. I loro risultati sono stati pubblicati online in ChemBioChem .
Il terminale N è definito come l'inizio della catena proteica in cui il gruppo amminico del primo blocco costitutivo dell'amminoacido è disponibile per reagire. Mirare specificamente al capolinea N è utile in quanto raramente è coinvolto nel ripiegamento delle proteine, rendendolo facilmente accessibile pur avendo un impatto minimo sulla funzione proteica. È noto per essere un sito unico e sempre presente all'interno di ogni proteina.
Ispirato da lavori precedenti, i ricercatori hanno esaminato una serie di composti ciclici contenenti azoto e hanno scoperto che 1H-1, 2, I derivati della 3-triazolo-4-carbaldeide (TA4C) possono essere coniugati all'N-terminale in un unico passaggio con conversioni relativamente elevate, fino al 92%.
"Semplificare la modifica delle proteine è uno sviluppo prezioso per una varietà di campi, ", spiega l'autore corrispondente Akira Onoda. "Il nostro approccio si traduce in un'etichettatura sito-specifica altamente efficiente in condizioni miti, che è importante quando si lavora con molecole biologiche sensibili. Finché la molecola da aggiungere contiene un gruppo amminico, è possibile eseguire una reazione per creare il gruppo TA4C in un unico passaggio, che è quindi reattivo verso il capolinea della proteina N."
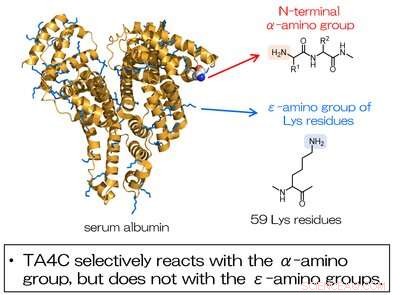
Fig. 2. La modifica dell'albumina sierica mediante TA4C procede selettivamente al gruppo α N-terminale e non ai gruppi amminici dei residui di Lys. Credito:Università di Osaka
I reagenti TA4C vengono preparati in un unico passaggio da una molecola funzionale con un gruppo amminico tramite una reazione nota come riarrangiamento di Dimroth. Sono state utilizzate con successo una varietà di molecole contenenti ammine, compreso il glicole polietilenico, biotina, e fluoresceina, dimostrando l'ampia gamma di funzionalità possibili.
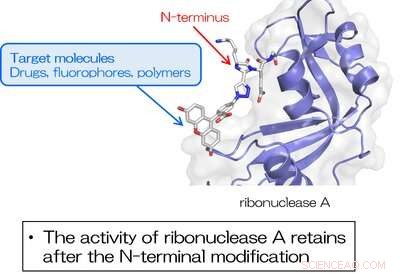
Fig. 3. La RNasi A modificata all'N-terminale utilizzando TA4C mantiene l'attività enzimatica intrinseca. Credito:Università di Osaka
"Riteniamo che il nostro approccio contribuirà come un'opzione estremamente pratica alla cassetta degli attrezzi per la modifica delle proteine e accelererà lo sviluppo in molte aree che si basano sulla coniugazione delle proteine, " spiega l'autore corrispondente Takashi Hayashi. "Inoltre, combinare il nostro approccio con tecniche che prendono di mira altri siti proteici consentirà l'introduzione di molteplici funzioni, fornendo una grande flessibilità. Ciò si rivelerà vantaggioso in un'ampia varietà di campi, tra cui la bioingegneria, prodotti farmaceutici, e diagnostica".