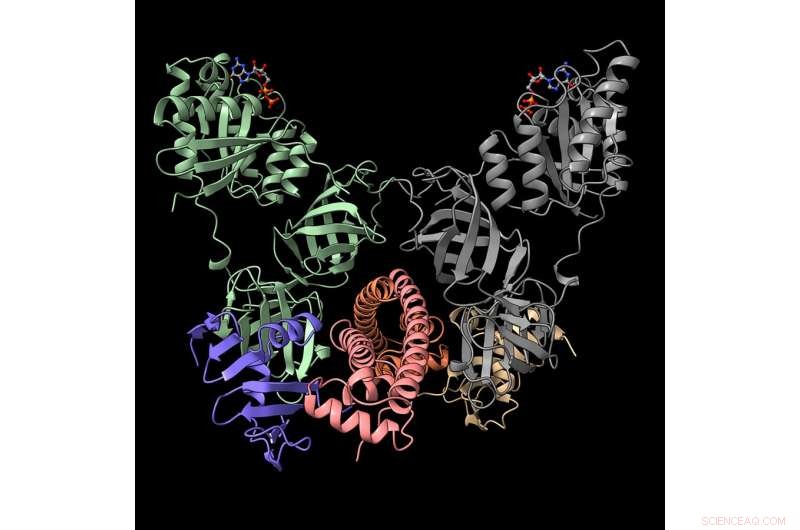
Gli scienziati di Argonne hanno determinato la struttura molecolare di questo complesso proteico, un'intuizione che potrebbe portare a nuove strategie biomediche per sconfiggere i batteri patogeni che causano malattie infettive. Questa rappresentazione mostra il complesso neutralizzato della tossina CdiA (viola e beige) con la proteina immunitaria CdiI (arancione e rosa) e il fattore di allungamento EF-Tu (grigio e verde). Credito:Karolina Michalska / Laboratorio nazionale Argonne
Ogni volta che utilizziamo i nostri smartphone per controllare i social media, affrontiamo un sacco di batteri sui dispositivi, anche più che sui sedili del water, secondo uno studio dell'Università dell'Arizona. Quei batteri possono avere una propria forma di social network che, come Facebook, permette alle creature unicellulari di attrarsi e respingersi a vicenda.
Questa intuizione deriva da una nuova ricerca degli scienziati del Dipartimento dell'Energia degli Stati Uniti (DOE) che hanno determinato le strutture molecolari di un insieme di proteine altamente specializzato. Queste proteine sono utilizzate da un ceppo di batteri E. coli per comunicare e difendere il proprio territorio.
Il lavoro potrebbe portare a nuove strategie biomediche per superare i batteri patogeni che causano malattie infettive come la polmonite e le malattie di origine alimentare. È l'ultimo progresso di un gruppo di scienziati dell'Argonne National Laboratory del DOE; l'Università della California, Santa Barbara (UCSB); e l'Università della California, Irvine.
Il lavoro si basa sulla scoperta del 2005 da parte dei ricercatori dell'UCSB che i batteri producono proteine tossiche, che possono trasferire ai loro vicini attraverso il contatto diretto per ucciderli o controllarli, possibilmente per ottenere un migliore accesso ai nutrienti. Si manifesta solo in comunità microbiche densamente popolate attraverso un processo chiamato inibizione della crescita dipendente dal contatto (CDI).
"Stiamo imparando come interagiscono e comunicano i batteri, " ha detto Andrzej Joachimiak, un illustre scienziato di Argonne nella divisione di bioscienze del laboratorio. "Abbiamo alcune idee che stiamo cercando di risolvere, perché le tossine possono avere attività diverse. Possono influenzare diversi batteri in modo diverso".
"Questi sistemi si trovano non solo nel suolo e nei batteri intestinali, ma anche in patogeni umani, " disse Gioacchino, che è anche senior fellow presso il Computation Institute dell'Università di Chicago. "Alcune di queste tossine dei sistemi CDI sono presenti in Pseudomonas aeruginosa, Per esempio, che è coinvolto nella malattia polmonare."
Joachimiak e 10 coautori hanno pubblicato i loro risultati il 29 settembre, Edizione 2017 della rivista Ricerca sugli acidi nucleici .
Il team di Argonne ha ottenuto le strutture molecolari delle proteine che appartengono a un sistema in tre parti del ceppo NC101 di E. coli. Le tre parti sono costituite dalla tossina CDI, la sua proteina immunitaria e il suo fattore di allungamento. Quest'ultimo, noto come EF-Tu, è una proteina che svolge un ruolo chiave nella sintesi proteica. Conoscere le strutture proteiche di tutte e tre le parti aiuta gli scienziati a comprenderne la funzione.
La scoperta della proteina immunitaria ha portato gli scienziati a sospettare che lo scopo del sistema includa non solo la competizione ma anche la segnalazione, il processo mediante il quale le cellule batteriche comunicano tra loro, oltre a uccidere e controllare altri batteri.
"Ci sono davvero solo poche molecole della tossina che entrano nella cellula vicina, "ha detto Karolina Michalska, un cristallografo proteico ad Argonne e co-autore dell'articolo. "È difficile stimare la reale entità del danno cellulare. Ecco perché pensavamo che non fosse destinato a uccidere, ma piuttosto per controllare e comunicare."
La tossina può agire sull'acido ribonucleico di trasferimento (tRNA) solo in circostanze altamente specifiche.
"Questa particolare tossina agisce sul tRNA e deve essere un insieme molto specifico di tRNA, " Ha detto Michalska. "Questo è il primo caso in cui vediamo il fattore di allungamento come questo componente aggiuntivo necessario per il funzionamento della tossina".
Il team di Argonne ha raccolto dati sulle strutture proteiche utilizzando la linea di luce del Centro di biologia strutturale presso l'Advanced Photon Source (APS), una struttura per gli utenti dell'Ufficio delle scienze del Dipartimento dell'energia. L'APS è una sorgente luminosa di terza generazione, fornendo raggi X estremamente luminosi che consentono ai ricercatori di approfondire gli array di molecole all'interno dei materiali. Utilizzando questo strumento, i ricercatori possono caratterizzare, o identificare, proteine biologiche e ispezionare i processi chimici su scala nanometrica (un miliardesimo di metro).
Il team di ricerca di Argonne ha anche sfruttato l'Advanced Protein Characterization Facility del laboratorio, che offre le tecnologie più avanzate della nazione per lo studio di nuove classi di proteine e complessi proteici.