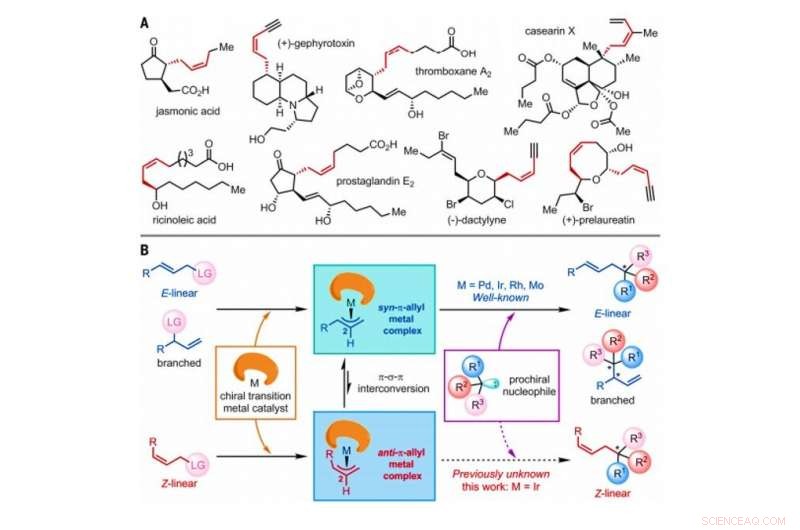
Strategia per la costruzione di Z-olefine tramite reazioni di sostituzione allilica asimmetrica catalizzate da catalizzatori di metalli di transizione. (A) Prodotti naturali selezionati contenenti Z-olefine con stereocentri omoallilici. Me, metile. (B) Meccanismo generale proposto di reazioni di sostituzione allilica asimmetrica catalizzate da metalli di transizione che coinvolgono E-lineare, ramificato, o substrati olefinici Z-lineari, tutto ciò include un atomo o un gruppo di atomi indicato come gruppo uscente (LG). Credito:Scienza, doi:10.1126/science.abd6095
Nella chimica organica sintetica, Le Z-olefine sono un obiettivo sintetico impegnativo da produrre in laboratorio a causa della loro relativa instabilità termodinamica. Le Z-olefine formano un composto insaturo con un C n h 2n formula che può essere facilmente isomerizzata. Reazioni analoghe utilizzate per sintetizzare prodotti Z-olefinici otticamente attivi sono rare. In un nuovo rapporto ora pubblicato su Scienza , Ru Jiang e un gruppo di ricerca presso l'Università dell'Accademia cinese delle scienze di Shanghai, Cina, dettagliata una reazione di sostituzione allilica asimmetrica catalizzata da iridio per mantenere le geometrie Z-olefina stabilendo uno stereocentro quaternario adiacente. Il team ha osservato la formazione di intermedi transitori anti-π-allil-iridio e la loro cattura da parte di nucleofili esterni (donatori di elettroni) prima dell'isomerizzazione per formare controparti syn-π-allil-iridio termodinamicamente più stabili. I risultati forniscono un metodo promettente per preparare composti Z-olefinici chirali in laboratorio.
olefine
L'isomero geometrico di tipo Z delle olefine è ampiamente osservato come strutture di base in natura. Tuttavia, Le Z-olefine sono relativamente meno stabili rispetto alle loro controparti di tipo E, e quindi, è difficile sintetizzarli selettivamente in chimica organica. I metodi comuni per accedere alle Z-olefine includono l'isomerizzazione fotoindotta di E-olefine, Sapendo olefinazione, metatesi incrociata selettiva per Z, Cross-coupling Z-ritentivo e addizione asimmetrica di nucleofili Z-allilboro a chetoni e immine. Le Z-olefine con uno stereocentro omoallilico sono spesso incorporate in diversi prodotti naturali e molecole bioattive per generare un notevole interesse nella chimica organica sintetica. I ricercatori hanno dimostrato la capacità di condurre reazioni di sostituzione allilica asimmetrica catalizzate da metalli di transizione tra cui molibdeno (Mo), palladio (Pd), iridio (Ir) e rodio (Rh). Dalla sua prima relazione nel 1997, Le reazioni di sostituzione allilica asimmetrica catalizzate da Ir hanno suscitato un'intensa attenzione a causa della loro natura regio- ed enantioselettiva eccezionalmente elevata. In questo lavoro, Jiang et al. hanno riportato reazioni di substrati allilici lineari Z con triptamine e triptofolo. Durante l'analisi completa dei meccanismi di reazione, hanno notato la formazione di complessi chiave anti-π-allil-iridio, prima dell'isomerizzazione per formare le controparti termodinamicamente stabili syn-π-allil-iridio.
Ambito del substrato delle reazioni di sostituzione allilica asimmetrica Z-ritentiva catalizzata da Ir di derivati indolici. Tutte le reazioni sono state condotte secondo le condizioni qui riportate, se non diversamente indicato. Il rapporto geometrico da tipo Z a tipo E (Z/E) e il rapporto diastereomerico (dr) sono stati determinati mediante analisi 1H NMR delle miscele grezze. Sono riportate le rese isolate di Z-3. I valori ee sono stati determinati mediante analisi di cromatografia liquida ad alta prestazione (HPLC) con una fase stazionaria chirale. L'asterisco indica un rapporto Z/E di 7:1. Il simbolo del pugnale singolo indica un rapporto Z/E di 8:1. Il simbolo del doppio pugnale indica che le reazioni sono state condotte per 1 giorno. Il simbolo della sezione indica un rapporto Z/E di 11:1. Il simbolo del paragrafo indica che le reazioni sono state condotte utilizzando (Z)-non-2-en-1-il acetato, [Ir(COD)Cl]2 (3 mol %), (S)-L1 (6 moli %), InBr3 (1,0 equivalente), e bromuro di tetrabutilammonio (0,5 equiv) in CHCl3 a 0°C. Il simbolo della sterlina indica che le reazioni sono state condotte utilizzando i corrispondenti acetati Z-allilici, [Ir(COD)Cl]2 (4,5 moli %), (S)-L2 (9 moli %), In(OTf)3 (0,5 equiv per Z-3aS e Z-3aT; 1 equiv per Z-3aU) in CHCl3 a -10°C per 2 giorni. Bn, benzile; Bu, butile; Et, etilico; SM, mesile; Ph, fenile; PMB, para-metossibenzile; p-Tol, para-tolile; Ts, tosile. Credito:Scienza, doi:10.1126/science.abd6095 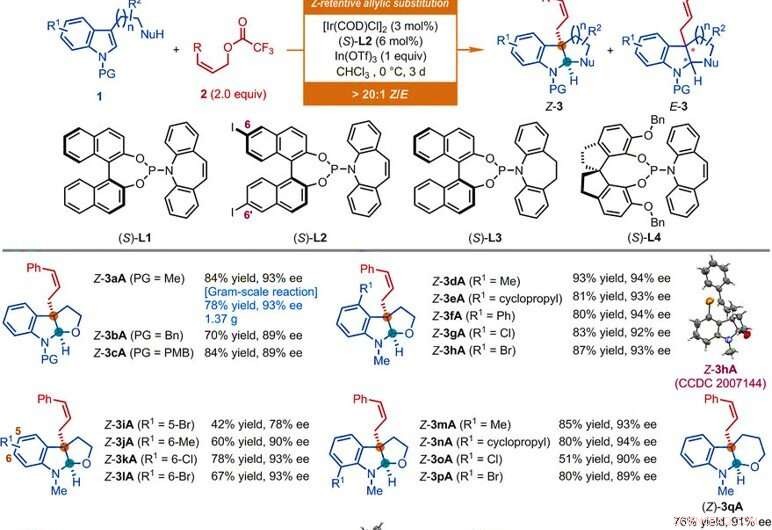
I ricercatori hanno prima studiato la reazione di de-aromatizzazione allilica asimmetrica che coinvolge nucleofili come l'N-metil triptopolo con derivati Z-cinnamil. Utilizzando Z-cinnamil acetato, hanno ottenuto la reazione desiderata con un catalizzatore derivato dal dimero di cloro iridio cicloottadiene (COD) in presenza di altri composti sintetici. Gli scienziati hanno ottenuto il prodotto target con resa moderata ed enantioselettività con un rapporto geometrico da tipo Z a tipo E di 2:1. Hanno quindi ottimizzato i costituenti per migliorare la qualità e la resa dei prodotti sintetici. Sulla base della proposta reazione di sostituzione allilica asimmetrica ritentiva Z, Jiang et al. ottenuto una diversa compatibilità del gruppo funzionale che tollerava un ampio ambito di substrato. Il team ha sintetizzato con successo più di 50 esempi di (omo)triptofoli, substrati triptamine e indolo recanti un nucleofilo a base di carbonio pendente utilizzando derivati Z-cinnamil. Quasi tutte le reazioni hanno fornito una resa di rapporti da tipo Z a tipo E maggiori di 20:1. Gli esempi includono le corrispondenti furoindoline Z-cinnamilate (abbreviate da Z-3aA a Z-3pA), tetraidropiranindolina (abbreviato Z-3qA), pirroloindolini (abbreviati da Z-3a'A a Z-3o'A) ed esaidrociclopentaindoli (abbreviati da Z-3a′′A a Z-3c′′A) con buone rese fino al 94 percento. In genere, la sostituzione di varie proprietà elettroniche e steriche nelle posizioni disponibili dell'anello indolico non ha avuto alcun impatto deleterio sull'efficienza o sull'enantioselettività della reazione. I ricercatori hanno stabilito le strutture e la configurazione assoluta dei prodotti utilizzando l'analisi cristallografica a raggi X. Hanno poi esaminato anche le prestazioni dei derivati D- e L-triptofano.
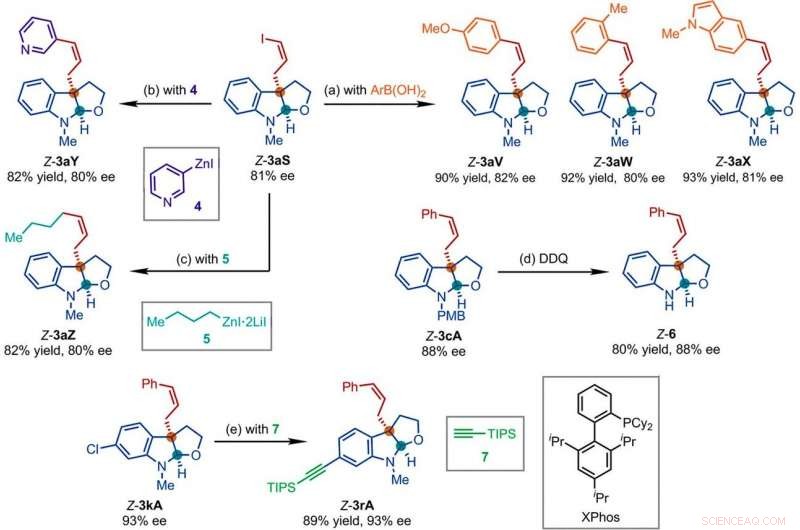
Prodotti rappresentativi ottenuti in successive reazioni con i prodotti della reazione di sostituzione allilica asimmetrica Z-ritentiva catalizzata da Ir. Condizioni di reazione:(a) Pd(PPh3)4 (0,5 mol %), Cs2CO3 (2 equivalenti), ArB(OH)2 (1,5 equivalenti), acetonitrile, 50°C; (b) 4 (2 equivalenti), THF/diglima (1:1), 110°C, 24 ore; (c) 5 (2 equivalenti), LiCl (4 equiv), toluene/THF/TMU, 110°C, 24 ore; (d) DDQ (1,5 equivalenti), CH2Cl2, NaH2PO4 (acquoso 1 M); (e) 7 (2 equivalenti), PdCl2(CH3CN)2 (5 moli %), Xphos (15 moli %), Cs2CO3 (2,5 equivalenti), acetonitrile, 80°C. Ar, arile; THF, tetraidrofurano; SUGGERIMENTI, triisopropilsilile; TMU, 1, 1, 3, 3-tetrametilurea. Credito:Scienza, doi:10.1126/science.abd6095
Trasformazioni a valle
I ricercatori hanno poi studiato come un certo numero di prodotti della reazione di sostituzione allilica asimmetrica ritentiva Z potrebbe essere facilmente studiata in diverse trasformazioni a valle. Per esempio, lo Z-vinil ioduro delle furoindoline chirali (abbreviato Z-3aS) era reattivo nei confronti degli acidi arilboronici e dei reagenti organozinco. Ciò ha fornito un percorso alternativo per produrre prodotti rappresentativi con catalizzatore Ir, Reazioni di sostituzione allilica asimmetrica Z-ritentiva con rese elevate fino all'82-93%. The scientists evaluated the proposed Z-retentive asymmetric allylic substitution reactions by a series of analyses. They obtained the Z-cinnamylated furoindolines (Z-3aA) product with optimal results in the presence of iridium atoms in the catalyst in a molar ratio of 1:1. They then characterized the key intermediates in the catalytic cycle and elucidated their structures using nuclear magnetic resonance (NMR) spectroscopy alongside X-ray crystallographic analysis. The team also monitored the reactions using electrospray ionization mass spectrometry and mechanistic studies. These results showed the isomerization of the complex from an anti- to the syn-π-allyl-iridium complex. Collettivamente, the analyses showed how the proposed Z-retentive asymmetric allylic substitution reaction successfully originated from the rapid and enantioselective capture of the transient anti-π-allyl-iridium complex by external nucleophiles, before converting it to more thermodynamically stable species.
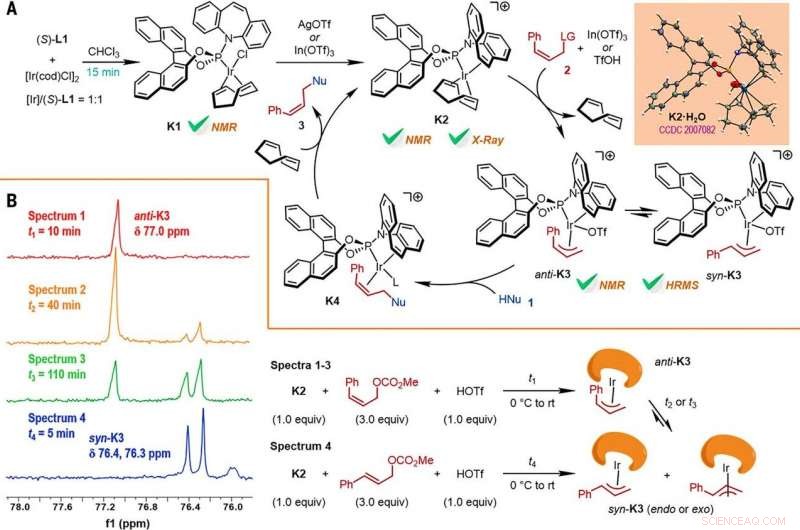
Reaction mechanism studies. (A) A proposed catalytic cycle. The key intermediates K1 and K2 were characterized by NMR spectroscopy, while K2•H2O was characterized by x-ray crystallographic analysis. HRMS, high-resolution mass spectrometry. (B) The reactions of K2 with Z- or E-cinnamyl methyl carbonate demonstrated isomerization from anti-K3 to syn-K3 according to the results of monitoring by electrospray ionization mass spectrometry (ESI-MS) and 31P NMR spectroscopy, the results of which are shown at left, with the details given by the reaction process diagrams to the right. Credit:Science, doi:10.1126/science.abd6095
Exploring the synthetic spectrum
The scientists also explored the extension of this iridium-catalyzed Z-retentive asymmetric allylic substitution reaction to other nucleophiles. Aside from the iridium catalysts containing Carreira-type chiral ligands that function under acidic conditions, they explored Ir catalysts derived from a Feringa-type chiral phosphoramidite ligand applied under basic conditions for this reaction mode. Di conseguenza, Jiang et al. used diverse nucleophiles beyond tryptophols and tryptamines. In questo caso, they formed the prochiral nucleophiles from a copper (Cu) source. The independently prepared chiral cyclometallated Ir complex promoted the development of the transient anti-π-allyl-iridium complexes as well as their regio- and enantio-selective captures. The broad scope of the reaction presented more than 30 synthetic samples in good yields with excellent enantioselectivity. The scientists investigated the structure and absolute configuration of the products using X-ray crystallographic analyses. When the team used Z-cinnamyl acetate, they obtained a mixture of the desired Z-cinnamylated product and its branched isomer. The results highlighted the possibility of using the proposed protocol to accommodate diverse prochiral nucleophiles in asymmetric allylic substitution reactions. The researchers expect the work to evolve into a broadly practical method to synthesize chiral Z-olefins in the lab.
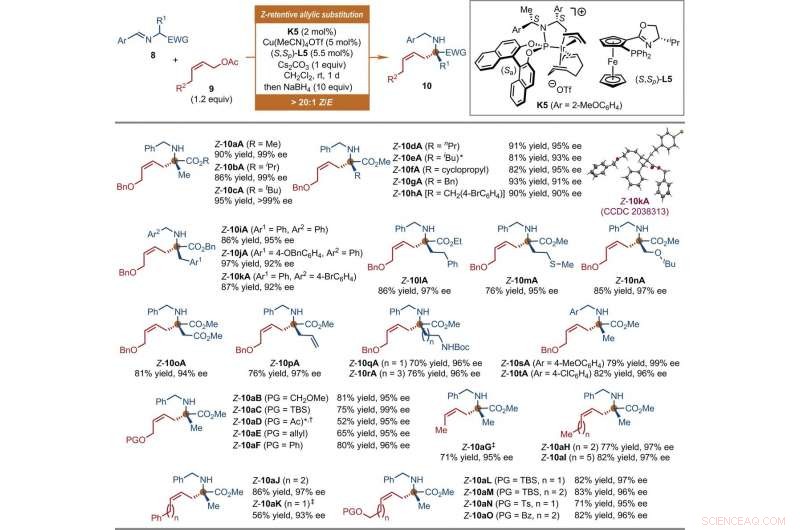
Substrate scope of Ir-catalyzed Z-retentive asymmetric allylic substitution reactions of a-amino acid derivatives. All reactions were conducted under the following conditions. Step 1:8 (0.2 mmol, 1 equiv), 9 (1.2 equiv), K5 (2 mol %), Cu(MeCN)4OTf (5 mol %), (S, Sp)-L5 (5.5 mol %), and Cs2CO3 (1 equiv) in CH2Cl2 (2 ml) at room temperature. Step 2:Reaction residue of step 1, NaBH4 (10 equiv) in CH2Cl2/MeOH (1:1, 4 ml) at room temperature. The Z-type to E-type geometric ratio (Z/E) values were determined by 1 H NMR analysis of the crude mixtures of step 1. The isolated yields of linear Z-10 are reported. The ee values were determined by HPLC analysis with a chiral stationary phase. The asterisk indicates that 9 (1.5 equiv) and K5 (4 mol %) were used. The single-dagger symbol indicates a Z/E ratio of 5.3:1. The double-dagger symbol indicates that 9 (2 equiv) was used. Ac, acetyl; Boc, tert-butoxycarbonyl; Bz, benzoyl; EWG, electron-withdrawing group; PG, protecting group; Pr, propyl; TBS, tert-butyldimethylsilyl. Credit:Science, doi:10.1126/science.abd6095
© 2021 Science X Network