La materia è disponibile in diverse dimensioni, forme e colori. Considera il cloro, un gas giallastro o piombo, un solido grigio-nero o mercurio, un liquido argenteo. Tre elementi molto diversi, ogni materiale costituito da un solo tipo di atomo. Le differenze nella materia si riducono alle più piccole differenze nella struttura atomica.
TL; DR (troppo lungo; non letto)
Comprendi che gli isotopi di un elemento hanno numeri di massa diversi ma il stesso numero di protoni. Usando la tavola periodica, trova il numero atomico dell'elemento. Il numero atomico è uguale al numero di protoni. In un atomo bilanciato, il numero di elettroni è uguale al numero di protoni. In un atomo sbilanciato, il numero di elettroni è uguale al numero di protoni più l'opposto della carica ionica. Calcola il numero di neutroni sottraendo il numero atomico dal numero di massa. Se il numero di massa di un isotopo specifico non è noto, utilizzare la massa atomica dalla tavola periodica, arrotondata al numero intero più vicino, meno il numero atomico per trovare il numero medio di neutroni per l'elemento.
Struttura degli atomi
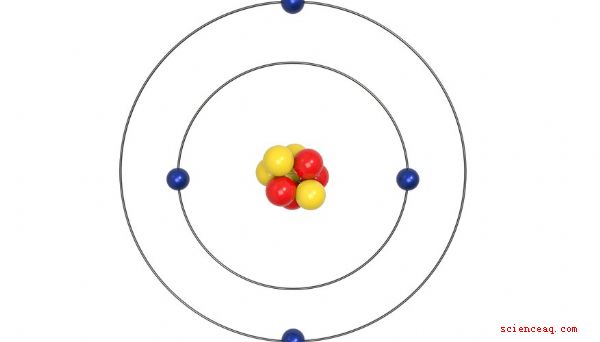
Tre particelle principali formano ogni atomo. Protoni e neutroni si raggruppano nel nucleo al centro dell'atomo. Gli elettroni formano una nuvola che gira intorno al nucleo. Protoni e neutroni formano la massa di atomi. Gli elettroni, minuscoli rispetto ai protoni e ai neutroni, contribuiscono molto poco alla massa complessiva degli atomi.
Atomi e isotopi
Gli atomi dello stesso elemento hanno lo stesso numero di protoni. Tutti gli atomi di rame hanno 29 protoni. Tutti gli atomi di elio hanno 2 protoni. Gli isotopi si verificano quando gli atomi dello stesso elemento hanno masse diverse. Poiché il numero di protoni di un elemento non cambia, la differenza di massa si verifica a causa del diverso numero di neutroni. Il rame, ad esempio, ha due isotopi, rame-63 e rame-65. Il rame-63 ha 29 protoni e un numero di massa di 63. Il rame-65 ha 29 protoni e il numero di massa 65. L'elio ha 2 protoni e quasi sempre ha un numero di massa di 4. Molto raramente, l'elio forma l'isotopo elio-3, che ha ancora 2 protoni ma ha un numero di massa di 3.
Un metodo per scrivere la formula per un isotopo mostra il nome o il simbolo dell'elemento seguito dal numero di massa, come elio-4 o He-4. Un'altra identificazione abbreviata di isotopi mostra il numero di massa come apice e il numero atomico come pedice, entrambi mostrati prima del simbolo atomico. Ad esempio, 4 2 Indica l'isotopo di elio con numero di massa 4. La disposizione della tavola periodica degli elementi fornisce informazioni essenziali per trovare il numero di protoni , neutroni ed elettroni negli atomi. La moderna tavola periodica mette gli elementi in ordine di protoni. Il primo elemento sul tavolo, l'idrogeno, ha un protone. L'ultimo elemento (almeno per ora) sul tavolo, Oganesson o Ununoctium, ha 118 protoni. Il numero atomico nella tavola periodica identifica il numero di protoni in qualsiasi atomo di ", 3, [[Il rame, numero atomico 29, ha 29 protoni. Trovare il numero atomico di un elemento rivela il numero di protoni. La differenza tra gli isotopi di un elemento dipende dal numero di neutroni. Per trovare il numero di neutroni in un isotopo, trova il numero di massa dell'isotopo e il numero atomico. Il numero atomico, o numero di protoni, si trova nella tavola periodica. La massa atomica, trovata anche nella tavola periodica, è la media ponderata di tutti gli isotopi dell'elemento. Se non viene identificato alcun isotopo, la massa atomica può essere arrotondata al numero intero più vicino e utilizzata per trovare il numero medio di neutroni. Ad esempio, la massa atomica di mercurio è 200.592. Il mercurio ha diversi isotopi con numeri di massa compresi tra 196 e 204. Usando la massa atomica media, calcola il numero medio di neutroni arrotondando prima la massa atomica da 200.592 a 201. Ora, sottrai il numero di protoni, 80, dalla massa atomica , 201-80, per trovare il numero medio di neutroni, 121. Se si conosce il numero di massa di un isotopo, è possibile calcolare il numero effettivo di neutroni. Utilizzare la stessa formula, numero di massa meno numero atomico, per calcolare il numero di neutroni. Nel caso del mercurio, l'isotopo più comune è il mercurio-202. Usa l'equazione, 202-80 \u003d 122, per scoprire che il mercurio-202 ha 122 neutroni. Un isotopo neutro non ha carica, il che significa che le cariche positive e negative si bilanciano in un isotopo neutro. In un isotopo neutro, il numero di elettroni è uguale al numero di protoni. Come trovare il numero di protoni, trovare il numero di elettroni in un isotopo neutro richiede di trovare il numero atomico dell'elemento. In uno ione, un isotopo con una carica positiva o negativa, il numero di protoni non t è uguale al numero di elettroni. Se i protoni sono più numerosi degli elettroni, l'isotopo ha più cariche positive che cariche negative. In altre parole, il numero di protoni supera il numero di elettroni dello stesso numero della carica positiva. Se il numero di elettroni supera il numero di protoni, la carica ionica sarà negativa. Per trovare il numero di elettroni, aggiungi l'opposto dello squilibrio di carica al numero di protoni. Ad esempio, se un isotopo ha una carica di -3, come con il fosforo (numero atomico 15), quindi il numero di elettroni è tre in più del numero di protoni. Il calcolo del numero di elettroni diventa quindi 15 + (- 1) (- 3) o 15 + 3 \u003d 18 o 18 elettroni. Se un isotopo ha una carica di +2, come con lo stronzio (numero atomico 38), il numero di elettroni è due in meno del numero di protoni. In questo caso, il calcolo diventa 38 + (- 1) (+ 2) \u003d 38-2 \u003d 36, quindi lo ione ha 36 elettroni. La solita scorciatoia per gli ioni mostra lo squilibrio di carica come apice che segue il simbolo atomico. Nell'esempio del fosforo, lo ione verrebbe scritto come P -3.
Tavola periodica degli elementi
Quanti protoni?
Quanti neutroni?
Quanti elettroni?