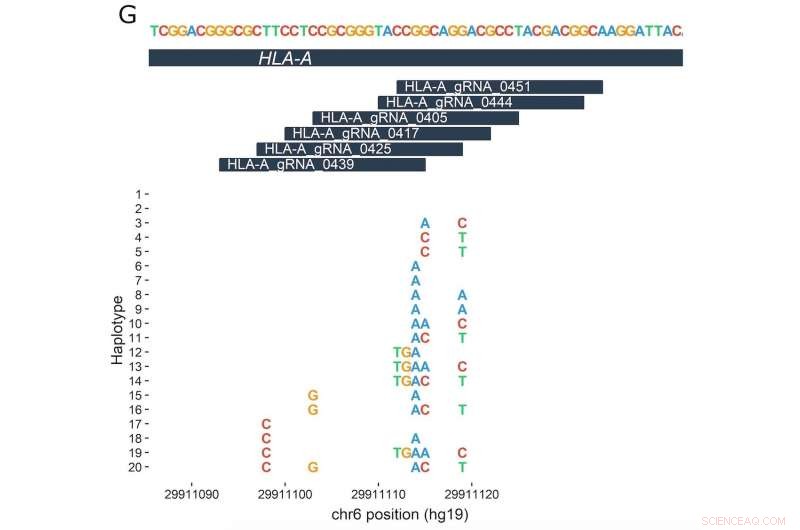
La parte superiore di questo diagramma mostra una regione di 30 paia di basi di un singolo locus genetico (HLA-A) che è coinvolto nella risposta immunitaria e potrebbe essere potenzialmente preso di mira con l'editing genico. Le sei barre più piccole sotto di essa rappresentano diversi RNA guida progettati per legarsi a parti diverse di quel locus HLA-A. Sull'asse Y (verticale) sono aplotipi con variazioni di DNA evidenziate identificate da individui diversi. Sono allineati secondo le loro posizioni nella sequenza genetica (rappresentata orizzontalmente sull'asse X). Credito:Lessard S; et al. PNAS prima edizione , settimana dell'11 dicembre 2017.
L'editing genetico ha iniziato a essere testato in studi clinici, utilizzando CRISPR-Cas9 e altre tecnologie per modificare direttamente il DNA all'interno delle cellule delle persone, e più studi sono in fase di reclutamento o in fase di pianificazione. Un nuovo studio condotto dal Boston Children's Hospital e dall'Università di Montreal solleva una nota di cautela, scoprire che le differenze genetiche da persona a persona possono minare l'efficacia del processo di editing genetico o, in casi più rari, causare un effetto "fuori bersaglio" potenzialmente pericoloso.
Lo studio aggiunge alla prova che potrebbe essere necessario adattare l'editing genico al genoma di ciascun paziente, per garantire che non ci siano varianti nella sequenza del DNA all'interno o in prossimità del gene preso di mira che potrebbero far fallire la tecnologia. I risultati appaiono questa settimana nel Atti dell'Accademia Nazionale delle Scienze (11-15 dicembre).
"Gli esseri umani variano nelle loro sequenze di DNA, e quella che viene considerata la sequenza di DNA "normale" di riferimento non può spiegare tutte queste differenze, "dice Stuart Orkin, dottore, del Dana-Farber Boston Children's Cancer and Blood Disorders Center e autore corrispondente dello studio con Matthew Canver, uno studente MD-PhD presso la Harvard Medical School. "Raccomandiamo che la variazione comune sia presa in considerazione nella progettazione di sistemi di targeting per l'editing terapeutico, per massimizzare l'efficacia e ridurre al minimo i potenziali problemi di sicurezza."
Lo studio ha analizzato 7, 444 sequenze dell'intero genoma precedentemente pubblicate. Sulla base di un elenco di circa 30 bersagli di DNA correlati alla malattia che i ricercatori sono interessati ad alterare attraverso l'editing genetico, i ricercatori hanno fatto un secondo elenco di quasi 3, 000 RNA guida (gRNA). Questi sono frammenti di codice genetico che sono stati sviluppati per indirizzare gli enzimi CRISPR-Cas9 alla giusta posizione di modifica sul bersaglio o adiacente ad esso, come l'indirizzo su una busta.
Il gruppo, guidato da Orkin, Canver e Samuel Lessard dell'Università di Montreal, poi guardò per vedere se qualcuno dei 7, 444 individui portavano varianti della sequenza del DNA ("cambiamenti di lettere" o inserzioni/delezioni) nelle aree che i gRNA stanno cercando.
"Se ci sono differenze genetiche nel sito che i reagenti CRISPR stanno prendendo di mira per la terapia, sei a rischio di riduzione dell'efficacia o fallimento del trattamento, " spiega Canver, che ha concepito e condotto lo studio nel laboratorio dell'ospedale pediatrico di Boston di Orkin. "Una differenza in una sola coppia di basi può causare una diminuzione dell'efficienza di legame a causa di una mancata corrispondenza con l'RNA guida. Nel complesso, questo può causare una riduzione dell'efficacia del trattamento".
Il team ha scoperto che tali eventi nel genoma non sono rari; circa il 50 percento dei gRNA analizzati aveva il potenziale per essere influenzato da varianti nei loro siti target. In alcuni casi, il team ha trovato varianti genetiche che fanno sì che le sequenze di DNA nel genoma corrispondano più da vicino a un gRNA che potrebbe potenzialmente portarlo nel posto sbagliato, determinando una modifica di un gene o di un'altra regione del DNA che non è destinata a essere mirata.
"In rari casi, c'era il potenziale per creare siti "fuori bersaglio" molto potenti - dove i reagenti CRISPR potevano legarsi e tagliare dove non erano destinati, " dice Canver. "Se capita che ci sia un effetto fuori bersaglio, dire, un gene oncosoppressore, sarebbe una grande preoccupazione".
Sebbene lo studio abbia esaminato l'editing del gene CRISPR-Cas9, i ricercatori ritengono che le loro scoperte si estendano ad altri strumenti di modifica genetica come le nucleasi a dita di zinco (ZFN) e le nucleasi effettrici TAL.
"Il tema unificante è che tutte queste tecnologie si basano sull'identificazione di tratti di basi del DNA in modo molto specifico, " dice Canver. "Allora, una variante che influenza la sequenza bersaglio potrebbe ridurre il legame dell'RNA guida. Le varianti possono anche portare al legame in nuovi siti che potrebbero potenzialmente causare danni. Poiché queste terapie di modificazione genetica continuano a svilupparsi e iniziano ad avvicinarsi alla clinica, è importante assicurarsi che ogni terapia sia adattata al paziente che verrà trattato".