
Petar Pajic, dottorando UB in scienze biologiche, prepara un campione di saliva per la separazione e l'analisi. Nel nuovo studio, il team ha utilizzato una tecnica di elettroforesi su gel per separare le mucine da altre proteine nella saliva di vari mammiferi. Credito:Douglas Levere / Università di Buffalo
Dalle lumache che ricoprono la melma alla saliva nelle nostre bocche, molti fluidi corporei scivolosi contengono muco. Allora come si è evoluta questa meraviglia della biologia?
Nei mammiferi, la risposta è molte volte, e spesso in modo sorprendente, secondo un nuovo studio sulle proteine chiamate mucine. Queste molecole hanno una varietà di funzioni, ma come famiglia sono conosciute come componenti del muco, dove contribuiscono alla consistenza appiccicosa della sostanza.
Attraverso un confronto dei geni della mucina in 49 specie di mammiferi, gli scienziati hanno identificato 15 casi in cui sembra che nuove mucine si siano evolute attraverso un processo additivo che ha trasformato una proteina non mucina in una mucina.
Gli scienziati propongono che ciascuno di questi eventi di "mucinizzazione" sia iniziato con una proteina che non era una mucina. Ad un certo punto, l'evoluzione ha aggiunto una nuova sezione su questa base non mucinica:quella costituita da una breve catena di blocchi costitutivi chiamati amminoacidi che sono decorati con molecole di zucchero. Nel tempo, questa nuova regione è stata duplicata, con l'aggiunta di più copie per allungare ulteriormente la proteina, rendendola una mucina.
Le regioni raddoppiate, chiamate "ripetizioni", sono fondamentali per la funzione di una mucina, affermano i ricercatori dell'Università di Buffalo Omer Gokcumen e Stefan Ruhl, gli autori senior dello studio, e Petar Pajic, il primo autore.
Gli zuccheri che ricoprono queste sezioni sporgono verso l'esterno come le setole di uno scovolino e conferiscono alle mucine la proprietà viscida che è vitale per molti importanti compiti che queste proteine svolgono.
La ricerca sarà pubblicata il 26 agosto su Science Advances.
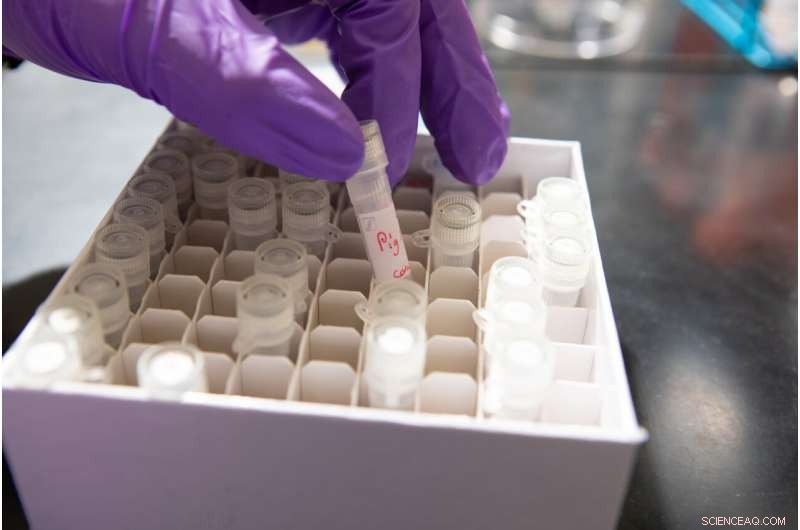
Fiale di saliva raccolte da vari mammiferi, incluso un maiale. Credito:Douglas Levere / Università di Buffalo
"Non credo che in precedenza si sapesse che la funzione proteica può evolversi in questo modo, da una proteina che ottiene sequenze ripetute. Una proteina che non è una mucina diventa una mucina solo guadagnando ripetizioni. Questo è un modo importante in cui l'evoluzione crea la melma . È un trucco evolutivo e ora documentiamo che ciò accade più e più volte", afferma Gokcumen, Ph.D., professore associato di scienze biologiche presso l'UB College of Arts and Sciences.
"Le ripetizioni che vediamo nelle mucine sono chiamate 'ripetizioni PTS' per il loro alto contenuto di aminoacidi prolina, treonina e serina e aiutano le mucine nelle loro importanti funzioni biologiche che vanno dalla lubrificazione e protezione delle superfici dei tessuti all'aiutare a rendere scivoloso il nostro cibo in modo che possiamo ingoiarlo", afferma Stefan Ruhl, DDS, Ph.D., preside ad interim della UB School of Dental Medicine e professore di biologia orale. "I microbi benefici si sono evoluti per vivere su superfici ricoperte di muco, mentre il muco può anche fungere da barriera protettiva e difendersi dalle malattie proteggendoci da intrusi patogeni indesiderati".
"Non molte persone sanno che la prima mucina che è stata purificata e caratterizzata biochimicamente proveniva da una ghiandola salivare", aggiunge Ruhl. "Il mio laboratorio ha studiato le mucine nella saliva negli ultimi 30 anni, principalmente perché proteggono i denti dalla carie e perché aiutano a bilanciare il microbiota nella cavità orale."
L'intrigante evoluzione di un 'incredibile tratto vitale'
"I think this paper is really interesting," Gokcumen says. "It's one of those times where we got lucky. We were studying saliva, and then we found something that's interesting and cool and decided to look into it."
While studying saliva, the team noticed that a small salivary mucin in humans called MUC7 was not present in mice. The rodents did, however, have a similarly sized salivary mucin called MUC10. The scientists wanted to know:Were these two proteins related from an evolutionary perspective?
La risposta è stata no. But what the research uncovered next was a surprise. While MUC10 did not appear to be related to MUC7, a protein found in human tears called PROL1 did share a portion of MUC10's structure. PROL1 looked a lot like MUC10, minus the sugar-coated bottlebrush repeats that make MUC10 a mucin.
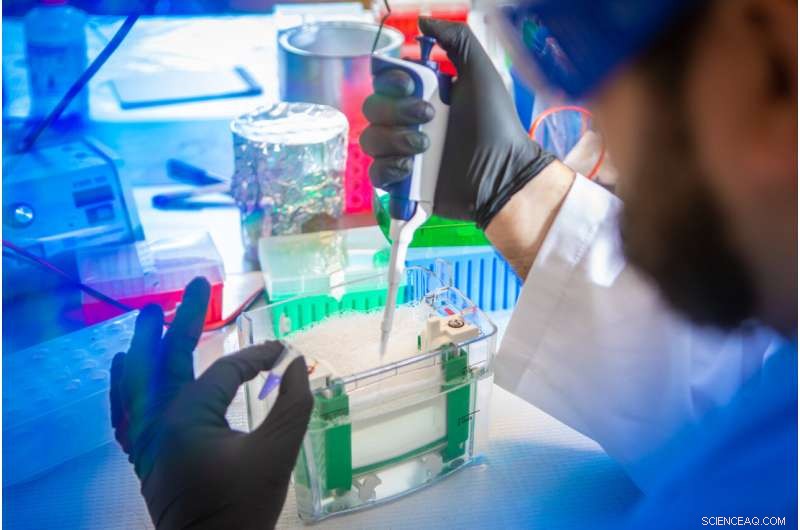
Petar Pajic, UB PhD student in biological sciences, uses a gel electrophoresis technique to separate mucins from other proteins in a saliva sample. Credit:Douglas Levere / University at Buffalo
"We think that somehow that tear gene ends up repurposed," Gokcumen says. "It gains the repeats that give it the mucin function, and it's now abundantly expressed in mouse and rat saliva."
The scientists wondered whether other mucins might have formed the same way. They began to investigate and discovered multiple examples of the same phenomena. Though many mucins share common ancestry among various groups of mammals, the team documented 15 instances in which evolution appeared to have converted non-mucin proteins into mucins via the addition of PTS repeats.
And this was "with a pretty conservative look," Gokcumen says, noting that the study focused on one region of the genome in a few dozen mammal species. He calls slime an "amazing life trait," and he's curious whether the same evolutionary mechanism might have driven the formation of some mucins in slugs, slime eels and other critters. More research is needed to find an answer.
"How new gene functions evolve is still a question we are asking today," says Pajic, a UB Ph.D. student in biological sciences. "Thus, we are adding to this discourse by providing evidence of a new mechanism, where gaining repeated sequences within a gene births a novel function."
"I think this could have even broader implications, both in understanding adaptive evolution and in possibly explaining certain disease-causing variants," Pajic adds. "If these mucins keep evolving from non-mucins over and over again in different species at different times, it suggests that there is some sort of adaptive pressure that makes it beneficial. And then, at the other end of the spectrum, maybe if this mechanism goes 'off the rails'—happening too much, or in the wrong tissue—then maybe it can lead to disease like certain cancers or mucosal illnesses."
The study on mucins demonstrates how a long-time partnership between evolutionary biologists and dental researchers at UB is yielding new insights into genes and proteins that are also important to human health.
"My team has been studying mucins for many decades, and my collaboration with Dr. Gokcumen has brought this research to a new level by revealing all these exciting novel insights into their evolutionary genetics," Ruhl says. "At this advanced stage of my career, it is also immensely gratifying to see that the flame of scientific curiosity is being carried on by a new generation of young investigators like Petar Pajic." + Esplora ulteriormente