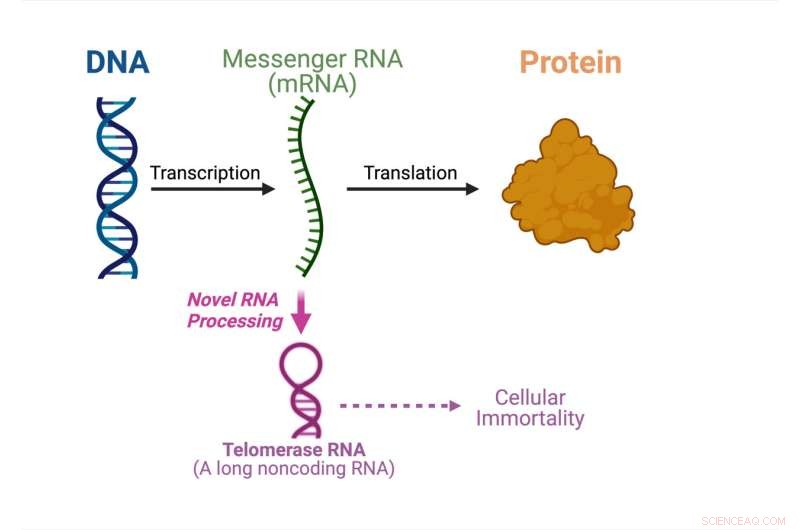
Il dogma centrale della biologia molecolare mostra ciò che sta accadendo in questo studio. Credito:Julian Chen
Per la prima volta, uno studio condotto da Julian Chen e dal suo gruppo presso la School of Molecular Sciences dell'Arizona State University e il Center for the Mechanism of Evolution del Biodesign Institute, ha scoperto un percorso senza precedenti che produce RNA della telomerasi da un RNA messaggero codificante una proteina ( mRNA).
Il dogma centrale della biologia molecolare specifica l'ordine in cui le informazioni genetiche vengono trasferite dal DNA per produrre proteine. Le molecole di RNA messaggero trasportano le informazioni genetiche dal DNA nel nucleo della cellula al citoplasma dove vengono prodotte le proteine. L'RNA messaggero funge da messaggero per costruire le proteine.
"In realtà, ci sono molti RNA (acidi ribonucleici) che non vengono utilizzati per produrre proteine", ha spiegato Chen. "Circa il 70 percento del genoma umano viene utilizzato per creare RNA non codificanti che non codificano per sequenze proteiche ma hanno altri usi".
L'RNA della telomerasi è uno degli RNA non codificanti che si assemblano insieme alle proteine della telomerasi per formare l'enzima telomerasi. La telomerasi è cruciale per l'immortalità cellulare nel cancro e nelle cellule staminali. In questo studio, il gruppo di Chen mostra che un RNA della telomerasi fungina viene elaborato da un mRNA codificante una proteina, invece di essere sintetizzato in modo indipendente.
"La nostra scoperta di questo documento sta cambiando paradigma. La maggior parte delle molecole di RNA sono sintetizzate in modo indipendente e qui abbiamo scoperto un mRNA a doppia funzione che può essere utilizzato per produrre una proteina o per creare un RNA telomerasi non codificante, che è davvero unico", ha affermato Chen. "Avremo bisogno di fare molte più ricerche per comprendere il meccanismo alla base di un percorso così insolito di biogenesi dell'RNA".
La ricerca di base sul metabolismo e la regolazione dell'mRNA ha portato a importanti applicazioni mediche. Ad esempio, diversi vaccini contro il COVID-19 utilizzano l'RNA messaggero come mezzo per produrre proteine spike virali. In questi vaccini, le molecole di mRNA vengono infine degradate e poi assorbite dai nostri corpi.
Questo nuovo approccio presenta vantaggi rispetto ai vaccini a DNA che corrono il potenziale rischio di essere incorporati in modo deleterio e permanente nel nostro DNA. La scoperta della biogenesi dell'mRNA a doppia funzione in questo lavoro potrebbe portare a modi innovativi per realizzare futuri vaccini mRNA.
In questo studio il gruppo di Chen ha scoperto l'inaspettato RNA della telomerasi derivato dall'mRNA nell'organismo fungino modello Ustilago maydis oppure granella di mais. La farina di mais, chiamata anche tartufo messicano, è commestibile e aggiunge un delizioso effetto umami a molti piatti, ad esempio tamales e tacos. Lo studio della biologia dell'RNA e dei telomeri nel fango del mais può fornire opportunità per trovare nuovi meccanismi per il metabolismo dell'mRNA e la biogenesi della telomerasi.
Perché studiare l'RNA della telomerasi?
Il Premio Nobel per la Fisiologia o la Medicina è stato assegnato nel 2009 "per la scoperta di come i cromosomi sono protetti dai telomeri e dall'enzima telomerasi". La telomerasi è stata isolata per la prima volta da un organismo unicellulare che viveva nella schiuma dello stagno. Come si è poi scoperto, la telomerasi esiste in quasi tutti gli organismi eucarioti, compreso l'uomo, e svolge un ruolo cruciale nell'invecchiamento e nel cancro. Gli scienziati si sono dati da fare per scoprire modi per utilizzare la telomerasi per rendere immortali le cellule umane.
Le tipiche cellule umane sono mortali e non possono rinnovarsi per sempre. Come dimostrato da Leonard Hayflick mezzo secolo fa, le cellule umane hanno una durata di vita replicativa limitata, con le cellule più vecchie che raggiungono questo limite prima delle cellule più giovani. Questo "limite di Hayflick" della durata della vita cellulare è direttamente correlato al numero di ripetizioni uniche del DNA che si trovano alle estremità dei cromosomi portatori di materiale genetico. Queste ripetizioni del DNA fanno parte delle strutture protettive di capping, denominate "telomeri", che salvaguardano le estremità dei cromosomi da riarrangiamenti del DNA indesiderati e ingiustificati che destabilizzano il genoma.
Ogni volta che la cellula si divide, il DNA telomerico si restringe e alla fine non riuscirà a fissare le estremità del cromosoma. Questa continua riduzione della lunghezza dei telomeri funziona come un "orologio molecolare" che conta alla rovescia fino alla fine della crescita cellulare.
La ridotta capacità di crescita delle cellule è fortemente associata al processo di invecchiamento, con la riduzione della popolazione cellulare che contribuisce direttamente alla debolezza, alla malattia e all'insufficienza d'organo.
Contrastare il processo di restringimento dei telomeri è la telomerasi, l'enzima che detiene unicamente la chiave per ritardare o addirittura invertire il processo di invecchiamento cellulare. La telomerasi compensa l'invecchiamento cellulare allungando i telomeri, aggiungendo ripetizioni del DNA perso per aggiungere tempo al conto alla rovescia dell'orologio molecolare, prolungando efficacemente la durata della vita della cellula.
La telomerasi allunga i telomeri sintetizzando ripetutamente ripetizioni di DNA molto brevi di sei nucleotidi, i mattoni del DNA, con la sequenza "GGTTAG" sulle estremità del cromosoma da uno stampo situato all'interno del componente RNA dell'enzima stesso.
Il graduale restringimento dei telomeri influisce negativamente sulla capacità replicativa delle cellule staminali umane, le cellule che ripristinano i tessuti danneggiati e/o ricostituiscono gli organi che invecchiano nel nostro corpo. L'attività della telomerasi nelle cellule staminali adulte semplicemente rallenta il conto alla rovescia dell'orologio molecolare e non immortala completamente queste cellule. Pertanto, le cellule staminali adulte si esauriscono negli individui anziani a causa dell'accorciamento della lunghezza dei telomeri che si traduce in un aumento dei tempi di guarigione e nella degradazione dei tessuti d'organo da popolazioni cellulari inadeguate.
Sfruttare tutto il potenziale della telomerasi
Comprendere la regolazione e la limitazione dell'enzima telomerasi promette di invertire l'accorciamento dei telomeri e l'invecchiamento cellulare con il potenziale di estendere la durata della vita umana e migliorare il benessere degli anziani.
Le malattie umane che includono la discheratosi congenita, l'anemia aplastica e la fibrosi polmonare idiopatica sono state geneticamente collegate a mutazioni che influenzano negativamente l'attività della telomerasi e/o accelerano la perdita della lunghezza dei telomeri. Questo accorciamento accelerato dei telomeri ricorda da vicino l'invecchiamento prematuro con un aumento del deterioramento degli organi e una durata della vita del paziente ridotta causata da popolazioni di cellule staminali criticamente insufficienti. L'aumento dell'attività della telomerasi è apparentemente il mezzo più promettente per curare queste malattie genetiche.
Mentre una maggiore attività della telomerasi potrebbe portare la giovinezza alle cellule che invecchiano e curare malattie simili all'invecchiamento precoce, una cosa troppo buona può essere dannosa per l'individuo. Proprio come le cellule staminali giovanili usano la telomerasi per compensare la perdita di lunghezza dei telomeri, le cellule tumorali impiegano la telomerasi per mantenere la loro crescita aberrante e distruttiva. L'aumento e la regolazione della funzione della telomerasi dovranno essere eseguiti con precisione, percorrendo una linea sottile tra il ringiovanimento cellulare e un aumentato rischio di sviluppo del cancro.
A differenza delle cellule staminali umane, le cellule somatiche costituiscono la stragrande maggioranza delle cellule del corpo umano e mancano di attività telomerasica. La carenza di telomerasi delle cellule somatiche umane riduce il rischio di sviluppo del cancro, poiché la telomerasi alimenta la crescita incontrollata delle cellule tumorali. Pertanto, non sono desiderati farmaci che aumentino l'attività della telomerasi indiscriminatamente in tutti i tipi di cellule. I farmaci a piccole molecole possono essere selezionati o progettati per aumentare l'attività della telomerasi esclusivamente all'interno delle cellule staminali per il trattamento di malattie e terapie antietà senza aumentare il rischio di cancro.
Lo studio della biogenesi dell'RNA della telomerasi nel fango del mais potrebbe svelare nuovi meccanismi per la regolazione della telomerasi e offrire nuove direzioni su come modulare o ingegnerizzare la telomerasi umana per innovazioni nello sviluppo di terapie antietà e antitumorali.
Questo studio, "Biogenesis of telomerase RNA from a protein-coding mRNA precursor", è stato appena pubblicato negli Proceedings of the National Academy of Sciences . Il team dell'ASU comprende i primi autori postdoc Dhenugen Logeswaran e l'ex ricercatore assistente professore Yang Li, la studentessa di dottorato Khadiza Akhter, l'ex postdoc Joshua Podlevsky (attualmente presso i Sandia National Labs, Albuquerque, New Mexico) e due studenti universitari Tamara Olson e Katherine Fosberg.
Chen ha anche commentato il calibro degli studenti universitari dell'ASU, Tamara Olson e Katherine Fosberg, che hanno lavorato nel suo laboratorio per oltre un anno. "Hanno trascorso molto tempo in laboratorio e sono stati completamente coinvolti nella nostra ricerca". + Esplora ulteriormente