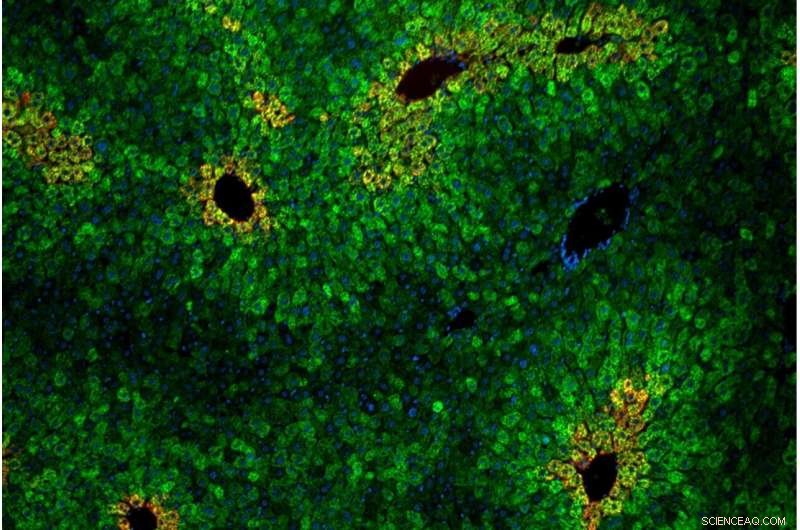
Le cellule del fegato sono disposte in "lobuli" di anelli concentrici di epatociti. Le cellule epatiche all'interno dei lobuli variano nella loro sensibilità all'amminoacido essenziale leucina. Credito Andrew Cangelosi/Whitehead Institute
Un nuovo articolo dei ricercatori del Whitehead Institute rivela come i topi percepiscono un amminoacido essenziale chiamato leucina, che molte persone ottengono mangiando pesce, uova o noci. In futuro, il lavoro potrebbe informare la ricerca sulla creazione di farmaci che prendono di mira parti specifiche di un percorso metabolico e di regolazione della crescita chiamato percorso mTOR per il trattamento di alcuni tumori o altre malattie metaboliche.
La leucina è necessaria per costruire e riparare i muscoli del corpo; se il corpo non può accedere a questo aminoacido dal cibo, la sua migliore linea d'azione è interrompere il metabolismo in alcuni tessuti fino a quando la risorsa non viene ripristinata. Ecco perché il rilevamento della leucina è importante:se il metabolismo dell'animale continua a funzionare come al solito senza leucina, i ricercatori hanno scoperto che l'animale essenzialmente si cannibalizza da solo, esaurendo le riserve di grasso e muscoli.
L'ex ricercatore del Whitehead Institute Andrew Cangelosi ha condotto lo studio mentre completava il suo dottorato di ricerca. nel laboratorio dell'ex membro del Whitehead Institute David Sabatini. "Le persone sapevano da molto tempo che gli amminoacidi regolano molto fortemente il percorso di mTOR, ma quando ho iniziato in laboratorio, era una grande scatola nera:stavamo appena iniziando a capire cosa stavano facendo e come stava accadendo." ha detto Cangelosi.
Negli ultimi 15 anni, i ricercatori, al Whitehead Institute e altrove, hanno messo in discussione alcuni dei meccanismi di come gli aminoacidi influenzano il percorso. "Una delle grandi intuizioni che ne è derivata è stata che il percorso si preoccupava di amminoacidi molto specifici", ha detto Cangelosi. Ci sono 20 aminoacidi utilizzati dalle cellule dei mammiferi per creare proteine e una manciata di questi, inclusa la leucina, ha un effetto molto più forte sulla via mTOR rispetto ad altri aminoacidi.
In un documento del 2014, i ricercatori del Whitehead Institute hanno scoperto che una famiglia di proteine chiamate Sestrins era responsabile della comunicazione della presenza di leucina alla via mTOR, in particolare mTORC1, il complesso di rilevamento dei nutrienti. (La proteina mTOR è un componente essenziale in due diversi complessi proteici, mTORC1 e mTORC2, che svolgono ruoli diversi nel corpo. mTORC1, è sensibile ai nutrienti e controlla la sintesi proteica e la crescita cellulare in risposta, mentre mTORC2 è coinvolto nella segnalazione cellulare e regolazione metabolica.) Nelle cellule in coltura, Sestrin1 e Sestrin2 inibiscono la segnalazione di mTORC1 interagendo e sopprimendo un complesso proteico chiamato GATOR2. Quando GATOR2 è soppresso, il percorso mTOR non può rimanere attivo.
Questa ricerca si è svolta nella coltura cellulare, tuttavia, quindi sono rimaste domande su come questo meccanismo si stesse esplicando nei topi vivi. "Studiare una popolazione cellulare omogenea in un piatto è molto diverso da in un animale", ha detto. "Volevamo davvero capire cosa significassero i risultati della coltura cellulare per ciò che fa la leucina nel corpo".
Cangelosi ha trascorso i suoi anni di laurea sviluppando modelli murini senza Sestrin per verificare se le proteine stessero svolgendo lo stesso ruolo nei modelli animali che avevano in un piatto. Ha poi nutrito questi topi, oltre ai topi di controllo, con una dieta completamente priva di leucina. Quando i topi normali sono stati privati della leucina, sono stati in grado di compensare disattivando il percorso mTOR e rallentando/fermando il metabolismo. Ma quando i topi senza Sestrins (e quindi la capacità di percepire la leucina) sono stati alimentati con una dieta priva di leucina, hanno perso drasticamente grasso e massa muscolare.
Come nella coltura cellulare, il percorso di rilevamento della leucina dipendeva dal complesso proteico GATOR2 ed era specifico di mTORC1 (non mTORC2). Una nuova intuizione dai modelli animali era che il rilevamento della leucina era concentrato in aree specifiche del fegato. Queste zone, chiamate lobuli epatici, sono disposizioni esagonali di cellule che dirigono il sangue ricco di sostanze nutritive dall'intestino attraverso il sistema di filtraggio del fegato e nella circolazione del corpo.
"Il fegato vede essenzialmente tutto ciò che mangi prima che lo faccia il resto del tuo corpo", ha detto Cangelosi. "Agisce come una sorta di passaggio di nutrienti nel corpo e diverse cellule del fegato hanno proprietà diverse a seconda della loro disposizione. Sembra decisamente che il corpo stia sfruttando le Sestrin per rendere il percorso mTOR sensibile o non sensibile alla leucina a seconda di dove deve essere o no."
L'intuizione che anche all'interno del fegato, non tutte le cellule rispondono allo stesso modo alla presenza o all'assenza di leucina suggerisce una visione più complessa di questo processo metabolico, ha detto Cangelosi. "Questo indica un modo molto nuovo in cui l'intero percorso funziona nel corpo:è cablato in modo diverso in contesti diversi in contesti diversi, in modo che la funzione metabolica cellulare possa essere effettivamente dettata dall'ambiente specifico della cellula o del tessuto". /P>
Sebbene alcuni medicinali siano progettati per indurre la perdita di grasso, Cangelosi ha sottolineato che la perdita di grasso osservata nei topi insensibili alla leucina non è salutare. "Non credo che potrebbe essere considerato vantaggioso", ha detto. "Il percorso mTOR è un processo di conservazione dei nutrienti che è importante e anche i topi hanno perso molta massa muscolare. Questa non è una sana riprogrammazione metabolica, è stata una risposta piuttosto negativa per i topi".
La ricerca di Cangelosi potrebbe però informare le terapie in altri modi. Comprendere come i processi correlati a mTOR si svolgono in modo diverso nei vari tipi di cellule potrebbe portare a terapie per alcuni tumori e altre malattie che influenzano il metabolismo cellulare. Attualmente i farmaci che prendono di mira mTOR, in particolare quelli basati sul farmaco immunosoppressore rapamicina, spesso si bloccano negli studi clinici a causa della mancanza di specificità.
"Quando [farmaci mirati a mTOR] vengono somministrati alle persone, il problema si riduce sempre al modo in cui interrompono in modo così ampio tutto ciò che fa mTOR", ha affermato Cangelosi. "Se abbiamo una migliore comprensione di come possiamo mirare in modo specifico a complessi mTOR distinti, e questo potrebbe essere un tiro lungo, ma se siamo in grado di identificare modi per colpire in regioni specifiche del corpo, anche cellule specifiche del corpo, che sono importanti per la data malattia o patologia che stiamo cercando di trattare, questi sarebbero fondamentali per sbarazzarsi degli effetti collaterali negativi che hanno limitato questo problema in clinica per così tanto tempo."
La ricerca è stata pubblicata su Scienza .