Una nuova ricerca ha scoperto che alcune proteine cambiano forma quando esposte a temperature diverse, rivelando siti di legame per i farmaci precedentemente sconosciuti.
I risultati, pubblicati su Nature , potrebbe rivoluzionare ampi settori della biologia modificando radicalmente il modo in cui la struttura delle proteine viene studiata e sfruttata per la progettazione dei farmaci. Lo studio è stato condotto da Juan Du, Ph.D. e Wei Lü, Ph.D. del Van Andel Institute.
Le proteine generalmente vengono studiate a basse temperature per garantirne la stabilità. Tuttavia, il nuovo studio dimostra che alcune proteine sono altamente sensibili alla temperatura e cambiano forma se osservate alla temperatura corporea.
"Per molto tempo, i metodi che abbiamo utilizzato per studiare le proteine richiedevano che fossero fredde o congelate. Ma nel mondo reale, le proteine umane esistono e funzionano alla temperatura corporea", ha detto Du. "Il nostro studio descrive un nuovo modo di studiare le proteine a temperatura corporea e rivela che alcune proteine alterano drasticamente le loro strutture quando sono calde, aprendo nuove opportunità per lo sviluppo di farmaci guidati dalla struttura."
Le proteine sono i cavalli di battaglia molecolari del corpo. La loro forma governa il modo in cui interagiscono con altre molecole per svolgere il loro lavoro. Determinando la struttura delle proteine, gli scienziati possono creare progetti che guidano lo sviluppo di farmaci più efficaci, proprio come i fabbri progettano le chiavi per inserirle in serrature specifiche.
Sebbene sia risaputo che la temperatura influisce sulla funzione molecolare del corpo, lo studio delle proteine a temperatura fisiologica è stato tecnologicamente impegnativo. Lo studio condotto dai laboratori Du e Lü descrive in dettaglio come sono riusciti a superare questi problemi e fornisce agli scienziati una tabella di marcia per farlo nei propri esperimenti.
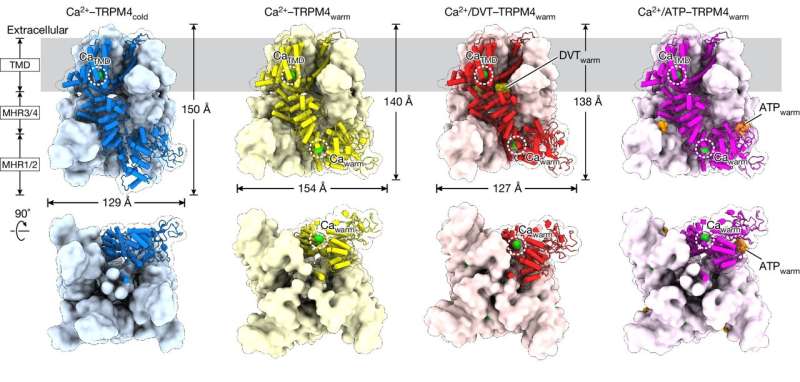
Lo studio si è concentrato su una proteina chiamata TRPM4, che supporta la funzione cardiaca e il metabolismo, compreso il rilascio di insulina. Pertanto, TRPM4 è collegato a ictus, malattie cardiache e diabete, tra le altre condizioni di salute.
Per visualizzare TRPM4 alla temperatura corporea, il team ha sfruttato la potente suite di microscopi crioelettronici (cryo-EM) del VAI, che consente agli scienziati di congelare rapidamente le proteine e assemblare immagini dettagliate delle loro strutture. Invece di utilizzare un campione a bassa temperatura, il ricercatore post-dottorato Jinhong Hu, Ph.D., e colleghi dei laboratori Du e Lü hanno riscaldato il campione alla temperatura corporea prima di congelarlo rapidamente. In questo modo, hanno scoperto che i ligandi, ovvero le molecole che si legano alle proteine, interagiscono con siti totalmente diversi su TRPM4 a temperatura corporea rispetto a temperature più basse.
Le implicazioni dello studio di oggi sono di vasta portata e rafforzano l'importanza dello studio delle proteine a temperatura corporea per garantire l'identificazione di siti di legame dei farmaci fisiologicamente rilevanti.
Altri autori includono Sung Jin Park, Ph.D., Tyler Walter, Ph.D., Ian J. Orozco, Ph.D., Garrett O'Dea e Xinyu Ye di VAI. I dati crio-EM sono stati raccolti presso il Cryo-EM Core di VAI e la suite di microscopia crioelettronica di David Van Andel.
Ulteriori informazioni: Jinhong Hu et al, La temperatura fisiologica guida il riconoscimento e il gating del ligando TRPM4, Natura (2024). DOI:10.1038/s41586-024-07436-7
Informazioni sul giornale: Natura
Fornito da Van Andel Research Institute