Gli scienziati dell'Istituto Leibniz di biochimica vegetale (IPB) sono riusciti per la prima volta a inserire in modo stabile e preciso grandi segmenti genetici nel DNA delle piante superiori in modo molto efficiente. Per fare ciò, hanno ottimizzato il metodo di modifica genetica CRISPR/Cas, comunemente noto come "forbici genetiche".
Il metodo CRISPR migliorato offre grandi opportunità per la modifica mirata dei geni nelle piante superiori, sia per la selezione che per la ricerca. Lo studio, condotto dal Prof. Alain Tissier e dal Dr. Tom Schreiber, è stato pubblicato su Molecular Plant .
CRISPR/Cas è un metodo con un enorme potenziale per la modifica mirata di singoli geni. Ciò però non vale per tutti i tipi di modificazioni genetiche che gli allevatori e gli scienziati hanno nella loro lista dei desideri. Mentre le forbici genetiche sono ideali per eliminare i geni, cioè spegnere o rimuovere i geni esistenti, non funzionano bene per inserire con precisione i geni o sostituire i segmenti genetici. Finora le forbici genetiche si sono rivelate troppo inefficienti e quindi di scarsa utilità per l'inserimento mirato di geni nel DNA delle piante superiori.
"La ragione di ciò è il meccanismo di riparazione interno dell'impianto per le rotture del DNA", afferma Schreiber. Questi enzimi riparatori sono immediatamente presenti non appena si verifica un danno al DNA. Riconoscono anche i tagli netti effettuati dalle forbici genetiche e ricongiungono istantaneamente i due filamenti di DNA recisi della doppia elica. Questo incollaggio del DNA tagliato avviene molto rapidamente e in modo non molto preciso; ci sono piccole perdite di informazioni in cui minuscole sezioni di DNA vengono perse o aggiunte.
"Queste imprecisioni non sono un problema nei progetti knock-out e sono addirittura auspicabili", dice Schreiber, "perché voglio comunque disattivare il gene. Ma se voglio inserire un gene, deve essere fatto in modo molto preciso. Il l'informazione genetica deve essere inserita esattamente, non deve mancare un solo componente e non deve essere integrato un solo componente aggiuntivo, altrimenti il gene perde la sua funzione e l'intero esperimento è vano."
Per questo motivo, l’inserimento preciso e senza cicatrici mediato da CRISPR/Cas di geni o segmenti di DNA più grandi è riuscito finora solo in rari casi individuali. Per aumentare la percentuale di successo dell'inserimento genico, gli scienziati di Halle hanno dotato le forbici genetiche di un enzima aggiuntivo, la cosiddetta esonucleasi.
Le esonucleasi possono alterare i siti di scissione del DNA creati dalle forbici genetiche in modo tale che gli enzimi di riparazione interni della cellula non possano più riconoscere e riparare il danno al DNA. Il segmento di DNA che verrà inserito da CRISPR/Cas avrebbe quindi abbastanza tempo per integrarsi nella posizione corretta attraverso un altro meccanismo di riparazione cellulare, molto preciso.
Nell'esperimento, gli scienziati di Halle hanno testato varie esonucleasi di origine virale, batterica, vegetale e umana per la loro capacità di aumentare il numero di precisi eventi di inserimento genico. Hanno introdotto le forbici genetiche con le corrispondenti esonucleasi e un segmento del gene X nelle cellule fogliari della pianta del tabacco Nicotiana benthamiana.
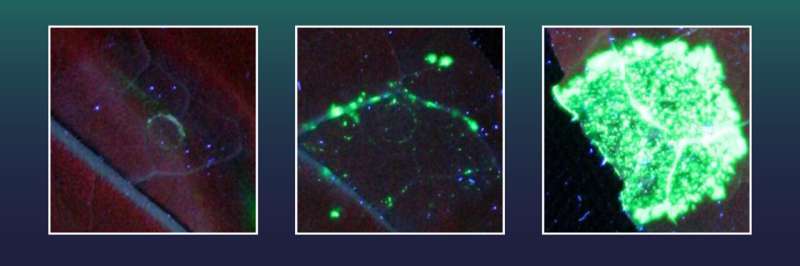
Queste cellule del tabacco erano state precedentemente dotate di un gene per un marcatore fluorescente verde. Contengono anche un gene X distrutto, necessario per la formazione del colorante fluorescente verde. Tuttavia, il marcatore fluorescente non può essere generato finché manca gran parte dell'informazione genetica del gene X.
Il marcatore verde può essere prodotto solo quando la sezione mancante del gene X viene reinserita con precisione utilizzando CRISPR/Cas, riparando così il gene X. Ogni cellula con inserimento genico riuscito diventerà quindi fluorescente in verde e i ricercatori potranno semplicemente contare il tasso di eventi di inserimento genico riusciti .
Due delle esonucleasi testate, tra cui una della famiglia dei virus dell'herpes, si sono rivelate particolarmente efficaci. Usandoli, il team di Halle ha ottenuto eventi di inserimento genico 38 volte più perfetti rispetto al solo CRISPR/Cas.
Questo approccio sperimentale è stato poi testato con altri geni da incorporare e in altre piante, in particolare il crescione (Arabidopsis thaliana) e il grano. Poiché l'inserimento del gene nelle piante di tabacco è avvenuto solo localmente nelle foglie, il gene integrato è andato perso nella generazione figlia successiva ed è stato quindi presente nel genoma solo per un periodo limitato.
Questo è il motivo per cui nell’Arabidopsis e nel grano gli esperti di Halle CRISPR hanno cercato di incorporare il gene nelle cellule germinali per garantire un’eredità stabile alle future generazioni di piante. Con l'aiuto delle esonucleasi testate, l'inserimento di geni stabili, cioè ereditabili, si è rivelato efficace nell'Arabidopsis con un aumento di dieci volte della frequenza e nel grano in oltre l'1% delle piante figlie.
"L'1% non sembra molto a prima vista," spiega Schreiber, "ma se un coltivatore vuole introdurre una determinata caratteristica nella sua pianta, dovrebbe selezionare solo circa 50-100 piante figlie di prima generazione utilizzando il nostro CRISPR ottimizzato /Cas per trovare una pianta con la caratteristica desiderata. Ciò farebbe risparmiare una notevole quantità di tempo rispetto ai metodi di selezione convenzionali, in cui a questo scopo dovrebbero essere analizzate da 500 a 1.000 piante."
Pertanto, il metodo CRISPR/Cas ottimizzato è uno strumento promettente per l’inserimento mirato di geni nelle piante superiori e possibilmente anche in altri organismi. In futuro, i coltivatori di piante potrebbero utilizzare questo metodo, ad esempio, per reintrodurre i geni di resistenza perduti contro gli agenti patogeni provenienti da specie selvatiche o antiche varietà coltivate in varietà d’élite moderne e ad alto rendimento. In questo modo, caratteristiche desiderabili come queste potrebbero migliorare la selezione delle piante e contribuire allo sviluppo di varietà di colture più robuste.
Per la scienza, questo approccio offre grandi opportunità per sostituire elegantemente alcuni geni delle piante con copie modificate di se stessi in un unico passaggio. Ciò è particolarmente utile per chiarire la funzione dei geni.
Ulteriori informazioni: Tom Schreiber et al, Efficienti knock-in senza cicatrici di diverse kilobasi nelle piante mediante endonucleasi CRISPR-Cas ingegnerizzate, Pianta molecolare (2024). DOI:10.1016/j.molp.2024.03.013
Informazioni sul giornale: Pianta molecolare
Fornito dall'Institut für Pflanzenbiochemie