Gli insetti bacianti, o insetti triatomini, sono il vettore principale della malattia di Chagas, un grave problema di salute pubblica nell'America centrale e meridionale e persino negli Stati Uniti meridionali. Tuttavia, non sono disponibili molte buone opzioni terapeutiche, il che significa che per fermare la diffusione della malattia potenzialmente pericolosa per la vita, è essenziale controllare gli organismi che trasportano il parassita.
Una nuova ricerca condotta da un team internazionale, tra cui un ricercatore della Penn State, dimostra, per la prima volta, l’uso dell’editing genetico CRISPR-Cas9 negli insetti bacianti e apre la porta alla ricerca sulle strategie applicate per il controllo della malattia di Chagas. I loro risultati compaiono nel numero cartaceo di aprile di The CRISPR Journal .
"Le persone hanno provato a fare CRISPR e ingegneria genetica nei batteri triatomini per molto tempo, ma nessuno è stato in grado di farlo perché i metodi tradizionali sono molto difficili in questi batteri", hanno affermato Jason Rasgon, Dorothy Foehr Huck e J. Lloyd Huck. Titolare della cattedra di epidemiologia e biotecnologia delle malattie e coautore dello studio.
"Negli ultimi sei anni abbiamo sviluppato strumenti per modificare geneticamente organismi difficili. In questo caso abbiamo dimostrato che è possibile modificare geneticamente questo insetto vettore. La nostra tecnologia ha il potenziale per rendere l'editing genetico più efficiente, più semplice ed economico in un'ampia gamma degli animali."
Quando si tratta di editing genetico, i ricercatori in genere eseguono le cosiddette microiniezioni embrionali, iniettando il materiale di editing genetico CRISPR direttamente negli embrioni. Ma la tecnica richiede attrezzature costose e può essere inefficiente senza alcuna garanzia che l’ingegneria genetica funzioni. Questa tecnica è difficile anche per baciare gli insetti perché le loro uova sono troppo difficili da forare.
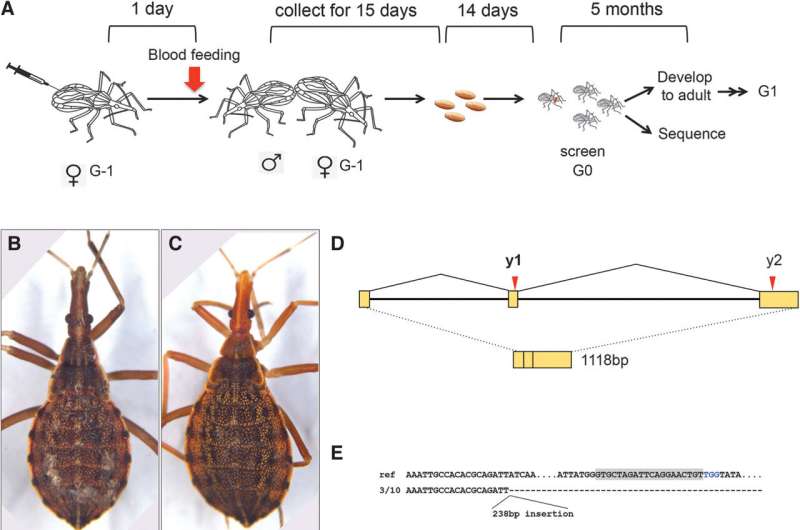
"Abbiamo invece sviluppato una tecnologia, la trasduzione del carico ovarico mediata dal recettore o 'ReMOT Control', in cui è possibile iniettare i materiali direttamente nel sistema circolatorio della madre e guidare quel materiale verso gli ovuli in via di sviluppo", ha detto Rasgon. "È l'equivalente di iniettarle ogni singolo uovo nel corpo allo stesso tempo."
L'obiettivo del team era condurre una prova di concetto della tecnologia ReMOT Control negli insetti triatomini. Hanno preso di mira i geni associati al colore degli occhi e alla cuticola, o al colore della copertura esterna. Dopo aver iniettato l'insetto del bacio femminile, il team ha esaminato la prole per vedere se avevano alterato il colore degli occhi o delle cuticole. I cambiamenti visibili indicavano che le modifiche genetiche avevano avuto successo e che i geni presi di mira erano stati cancellati.
Gli insetti bacianti sono anche un sistema modello per studiare la fisiologia degli insetti. Lo sviluppo di questo nuovo protocollo consentirà agli scienziati di indagare su questioni biologiche fondamentali sugli insetti e sulla trasmissione delle malattie, hanno affermato i ricercatori.
"Ciò ha importanti implicazioni per la ricerca di base, ma introduce anche i batteri triatominici e la malattia di Chagas nelle conversazioni sulle tecnologie genetiche per il controllo degli agenti patogeni trasmessi da vettori", ha affermato Rasgon. "Siamo sul punto di avere a disposizione la tecnologia e gli strumenti per poterlo fare."
Altri autori dell'articolo includono:Helena Araujo, Leonardo Lima, Mateus Berni, Jamile Mota, Daniel Bressan, Alison Julio e Robson Cavalcante dell'Istituto di scienze biomediche, Università federale di Rio de Janeiro; Vanessa Macias del Dipartimento di Scienze Biologiche, Università del Nord Texas; ed Ethan Bier e Zhiqian Li del Dipartimento di biologia cellulare e dello sviluppo, Università della California, San Diego.
Ulteriori informazioni: Leonardo Lima et al, Modifica genetica nel vettore della malattia di Chagas Rhodnius prolixus mediante ReMOT Control mediato da Cas9, The CRISPR Journal (2024). DOI:10.1089/crispr.2023.0076
Fornito dalla Pennsylvania State University