L'energia chimica ha origine nelle interazioni tra atomi e molecole. Generalmente, c'è un riarrangiamento di elettroni e protoni, chiamato reazione chimica, che produce cariche elettriche. La legge di conservazione dell'energia stabilisce che l'energia può essere trasformata o convertita ma mai distrutta. Pertanto, una reazione chimica che diminuisce l'energia in un sistema contribuirà all'energia persa per l'ambiente, solitamente come calore o luce. In alternativa, una reazione chimica che aumenta l'energia in un sistema avrà preso questa energia aggiuntiva dall'ambiente.
Reazioni organiche
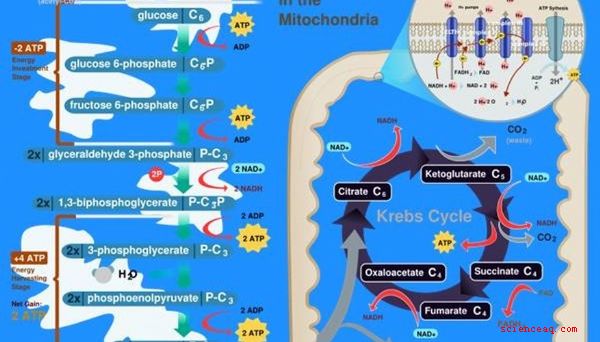
La vita biologica dipende dall'energia chimica. Le due fonti più comuni di energia chimica biologica sono la fotosintesi nelle piante e la respirazione negli animali. Nella fotosintesi, le piante usano uno speciale pigmento chiamato clorofilla per separare l'acqua in idrogeno e ossigeno. L'idrogeno viene quindi combinato con il carbonio proveniente dall'ambiente per produrre molecole di carboidrati che la pianta può utilizzare come energia. La respirazione cellulare è il processo inverso, che utilizza l'ossigeno per ossidare o bruciare una molecola di carboidrati come il glucosio in una molecola portatrice di energia chiamata ATP, che può essere utilizzata da singole cellule.
Reazioni inorganiche
Sebbene all'inizio non sembri ovvio, la combustione come avviene nei motori a gas è una reazione chimica biologica che utilizza l'ossigeno nell'aria per bruciare carburante e alimentare un albero motore. La benzina è un combustibile fossile derivato da composti organici. Ma non tutta l'energia chimica è biologica, ovviamente. Qualsiasi cambiamento nei legami chimici di una molecola comporta il trasferimento di energia chimica. La combustione del fosforo all'estremità di un fiammifero è una reazione chimica che produce energia chimica sotto forma di luce e calore usando il calore proveniente dal colpire per avviare il processo e l'ossigeno dall'aria per continuare a bruciare. L'energia chimica prodotta da una bacchetta attivata è per lo più leggera con pochissimo calore.
Reaction Rate
Le reazioni chimiche inorganiche sono spesso utilizzate per sintetizzare i prodotti desiderati o per ridurne quelli indesiderati. La gamma di reazioni chimiche che producono energia chimica è piuttosto vasta, che va dalla semplice riorganizzazione di una singola molecola o semplice combinazione di due molecole, a interazioni complesse con più composti di vari livelli di pH. La velocità di una reazione chimica dipende generalmente dalla concentrazione dei materiali reagenti, dalla superficie disponibile tra questi reagenti, dalla temperatura e dalla pressione del sistema. Una determinata reazione avrà una frequenza regolare date queste variabili e può essere controllata dagli ingegneri che manipolano questi fattori.
Catalizzatori
In alcuni casi, è necessaria la presenza di un catalizzatore per iniziare una reazione o per creare un tasso significativo di reazione. Poiché il catalizzatore non è a sua volta modificato nella reazione, può essere utilizzato più e più volte. Un esempio comune è il convertitore catalitico in un sistema di scarico di automobili. La presenza di metalli del gruppo del platino e di altri catalizzatori riduce le sostanze nocive in sostanze più benigne. Le reazioni tipiche in un convertitore catalitico sono la riduzione degli ossidi di azoto in azoto e ossigeno, l'ossidazione del monossido di carbonio in anidride carbonica e l'ossidazione degli idrocarburi incombusti in anidride carbonica e acqua.