Nuovo sistema organocatalitico per generare selettivamente diastereomeri in alta resa e selettività. Credito:Università di Nagoya
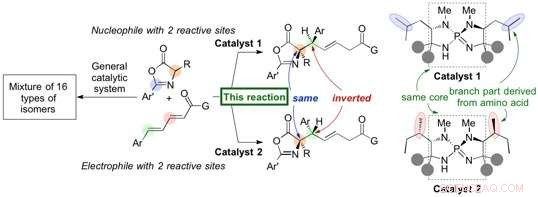
I ricercatori dell'Università di Nagoya hanno riferito in Comunicazioni sulla natura sullo sviluppo di un catalizzatore organico (organocatalizzatore) che inneschi un effetto altamente stereoselettivo 1, 6-aggiunta di azlattoni (nucleofili) a un composto δ-aril dienil carbonilico (elettrofilo) per generare derivati di amminoacidi con rese elevate. Il generato 1, 6-addotto contiene due stereocentri di carbonio, e un leggero cambiamento strutturale nell'organocatalizzatore porta all'inversione della stereochimica in un singolo stereocentro per formare un diastereomero ad alta selettività. Il gruppo ha iniziato questa ricerca nel 2012 e ha scoperto questa inversione della stereochimica sullo screening di vari amminoacidi incorporati nel loro catalizzatore unico di iminofosforano.
Molte molecole con usi farmaceutici contengono stereocentri (centri chirali, dove un atomo ha tre o più atomi o gruppi funzionali diversi ad esso collegati). I ricercatori cercano lo sviluppo di reazioni stereoselettive efficienti per sintetizzare un particolare stereoisomero (isomeri che differiscono negli orientamenti tridimensionali dei loro atomi nello spazio). Ogni stereoisomero ha solitamente caratteristiche diverse ed è necessario un controllo preciso per ottenere lo stereoisomero desiderato in forma pura.
Quando si collegano atomi di carbonio a cui sono collegati tre diversi gruppi funzionali, questo può risultare in una serie di stereoisomeri, in cui i gruppi funzionali sono diversamente orientati nello spazio.
Gli enantiomeri sono un tipo di stereoisomero che contiene uno o più stereocentri e sono immagini speculari l'uno dell'altro. Finora, numerose reazioni asimmetriche sono state sviluppate per generare centri chirali in alta efficienza. I diastereomeri sono stereoisomeri di un composto che hanno configurazioni diverse in uno o più stereocentri e non sono immagini speculari l'uno dell'altro.
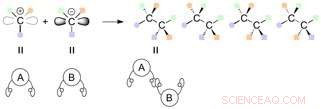
Le reazioni tra carboni contenenti tre diversi gruppi funzionali possono potenzialmente portare alla generazione di 4 prodotti i cui gruppi funzionali sono orientati diversamente nello spazio (stereoisomeri). Credito:Università di Nagoya
Una coppia di molecole di carbonio con due mani diverse può essere collegata in una varietà di combinazioni, e in teoria si possono sintetizzare quattro diversi stereoisomeri. Questi stereoisomeri sono una serie di enantiomeri e diastereomeri a seconda della relazione tra loro (immagine speculare o meno). I metodi convenzionali per sintetizzare i diastereomeri hanno richiesto un catalizzatore specifico per ciascun isomero. Nella maggior parte dei casi, è necessario un sistema catalitico completamente nuovo per ottenere in modo specifico uno degli stereoisomeri.
Quando due molecole da collegare hanno ciascuna quattro mani diverse, la situazione si complica e porta potenzialmente a 16 (24) tipi di stereoisomeri. Poiché la reazione può ora avvenire in posizioni diverse, sorge anche la possibile generazione di regioisomeri (isomeri posizionali). Per creare uno specifico stereoisomero (regioisomero, enantiomero, o diastereomero), è necessario stabilire un sistema di reazione affinché i materiali di partenza reagiscano in un sito specifico e con un orientamento specifico, cioè per le molecole da posizionare per tenersi per mano in un modo particolare.
Il gruppo del professor Takashi Ooi presso l'Institute of Transformative Bio-Molecules (ITbM) dell'Università di Nagoya ha sviluppato catalizzatori di iminofosforano in grado di generare stereoisomeri specifici in alta resa e selettività. Inoltre, un leggero cambiamento nella struttura organocatalizzatore porta all'inversione puntuale di un singolo stereocentro per generare un diastereomero, consentire l'accesso a un particolare diastereomero di interesse in forma pura.
"Ero davvero emozionato nel momento in cui ho visto l'inversione nella stereochimica cambiando l'organocatalizzatore, "dice Ken Yoshioka, uno studente laureato nel gruppo di ricerca del professor Ooi. "Inizialmente, stavamo cercando di espandere la portata del nostro sistema catalitico a nuovi substrati, quindi questo è stato anche il momento in cui ho pensato che questa fosse più di una normale reazione stereoselettiva".
Il catalizzatore imminofosforano è derivato da amminoacidi, e un cambiamento nella struttura degli amminoacidi può regolare le proprietà del catalizzatore. In questo caso, un leggero cambiamento nella posizione dei gruppi metilici sul catalizzatore ha portato al diastereomero dell'1, 6-addotto.
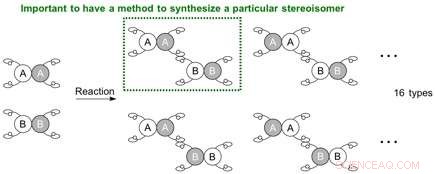
Possibile combinazione di stereoisomeri che si possono generare dalla reazione tra molecole che hanno ciascuna 4 mani diverse. Credito:Università di Nagoya
"Da quando abbiamo iniziato questa ricerca cinque anni fa, mi ci sono voluti circa tre anni per trovare le condizioni di reazione ottimali dopo aver trovato la reazione di inversione stereochimica, " continua Yoshioka. "Un problema principale era la riproducibilità di questa reazione, poiché le selettività variavano in ciascuna reazione. Avevo ripetuto la reazione più e più volte per vedere cosa stava succedendo".
"Eravamo davvero confusi da questi risultati variabili, e inizialmente abbiamo ipotizzato che la presenza di acqua stesse giocando un ruolo nello stato di transizione e stesse influenzando la selettività di questa reazione, "dice Actarus Uraguchi, Professore Associato presso l'Università di Nagoya. La rimozione completa dell'acqua è difficile negli organocatalizzatori in quanto sono in grado di formare legami idrogeno con molecole d'acqua.
"Dopo vari studi di ottimizzazione, siamo stati in grado di scoprire che abbassare la temperatura a -30 ° C era la chiave per controllare la selettività di questo 1, reazione di 6-addizione, " dice Yoshioka. "Ci è voluto un po' di tempo per capirlo, e siamo stati sollevati di essere in grado di generare risultati affidabili. Siamo stati anche in grado di sintetizzare stereospecificamente derivati della prolina diversamente funzionalizzati mediante ulteriori reazioni del 1, 6-addotti."
"Abbiamo quindi effettuato studi sperimentali e computazionali per trovare una logica per questa inversione stereochimica unica, " spiega Uraguchi. "Gli organocatalizzatori che portano a diversi diastereomeri condividono lo stesso nucleo e volevamo scoprire come la posizione dei gruppi metilici sul catalizzatore influenzi la diastereoselettività di questa reazione".
L'analisi mediante cristallografia a raggi X e studi DFT (teoria del funzionale della densità) ha rivelato che la forma del catalizzatore ha un ruolo importante nel posizionamento dei substrati per la reazione l'uno con l'altro. "Anche se i gruppi metilici sembrano essere all'esterno del catalizzatore, in realtà hanno un'enorme influenza sul mantenimento dei substrati in posizione per reagire su una particolare faccia, " dice Uraguchi. "Siamo stati in grado di dimostrare che una piccola differenza nella struttura del catalizzatore cambia lo stato di transizione, e porta ad un cambiamento nella diastereoselettività.
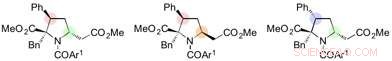
Derivati della prolina sintetizzati dal 1, 6-addotti. Credito:Università di Nagoya
La diastereodivergenza (realizzare diastereomeri da un insieme comune di substrati) è stato un argomento impegnativo, ma il gruppo è riuscito a sviluppare una nuova strategia per l'inversione della stereochimica mediante il loro sistema di reazione unico.
"Ho lavorato a questo progetto durante tutto il corso dei miei studi universitari e credo che la mia perseveranza sia stata ripagata, " dice Yoshioka. "Anche se ci sono stati momenti in cui non eravamo sicuri di ciò che stava accadendo nella reazione, abbiamo controllato ogni fattore uno per uno ed è stata una grande soddisfazione scoprire l'origine della stereoselettività."
"Siamo stati lieti di realizzare la diastereodivergenza in 1, 6 reazioni di addizione con alti livelli di stereocontrollo, e prevedere che questa strategia diastereodivergente farà avanzare il campo della sintesi asimmetrica, "dice Uraguchi e Takashi Ooi, un professore all'Università di Nagoya, che ha condotto questo studio. "Speriamo di continuare a creare catalizzatori unici che contribuiranno a creare molecole complesse, che avranno potenziali usi nelle industrie farmaceutiche e agrochimiche, "dice Ooi.