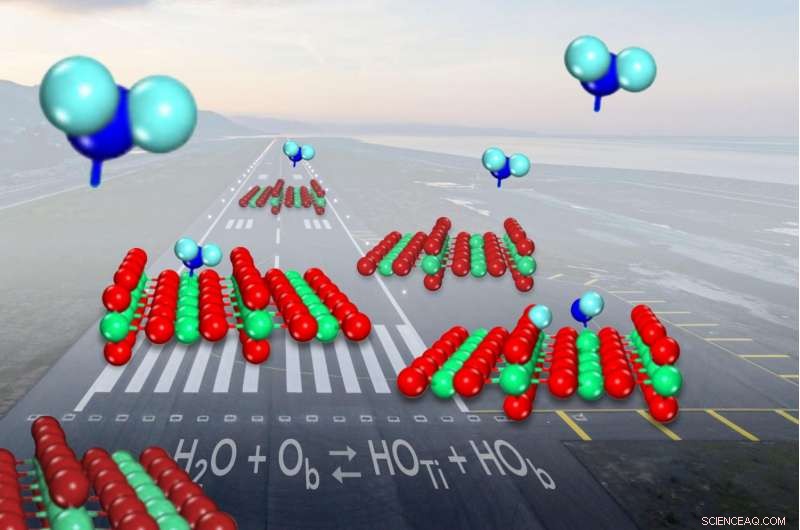
Quando l'acqua (mostrata in blu) entra per atterrare sul comune catalizzatore ossido di titanio (mostrato in rosso e verde), si divide in idrossili (sulla superficie sinistra) poco meno della metà delle volte. Attestazione:Zdenek Dohnalek
Quando una molecola d'acqua arriva per atterrare sul comune catalizzatore ossido di titanio, a volte si rompe e forma una coppia di frammenti di molecole noti come idrossili. Ma gli scienziati non erano stati in grado di mostrare quanto spesso avvenisse la rottura. Ora, i ricercatori hanno determinato che l'acqua ha solo leggermente più probabilità di rimanere in un unico pezzo poiché si lega alla superficie del catalizzatore piuttosto che formare le coppie di ossidrili.
Il risultato - il vantaggio dell'acqua è così piccolo - potrebbe sorprendere alcuni chimici. Ma comprendere quel piccolo vantaggio ha un significato ad ampio raggio per una varietà di potenziali applicazioni nelle industrie che utilizzano il biossido di titanio. Queste industrie includono la produzione di combustibili alternativi, energia solare e sicurezza alimentare, e persino finestre autopulenti. Aiuterà anche gli scienziati a capire meglio come si comportano gli acidi e ad ampliare le loro conoscenze su come le molecole si scindono.
"Come si lega l'acqua era la grande domanda, " ha detto il chimico Zdenek Dohnalek del Pacific Northwest National Laboratory del Department of Energy. "I chimici avevano informazioni miste da molti metodi diversi, e anche i teorici avevano idee. Utilizzando una combinazione unica di strumenti, abbiamo finalmente risolto".
Il team ha riportato il lavoro in Atti dell'Accademia Nazionale delle Scienze .
Terra di mistero
Anche se molte industrie utilizzano l'ossido di titanio per accelerare le reazioni chimiche, gli scienziati non hanno scoperto tutti i suoi segreti. Un mistero chiave, i ricercatori hanno a lungo discusso, è il modo in cui l'acqua interagisce con l'ossido di titanio. L'interazione è importante di per sé per dividere l'acqua, ma influenza anche il corso di molte reazioni in generale.
Sulla superficie dell'ossido di titanio, le molecole d'acqua passano dall'essere intatte alla scissione in idrossili. Anche se ci sono molti modi diversi per misurare il rapporto tra acqua intatta e idrossili in un dato momento, gli scienziati non sono stati in grado di inchiodarlo per decenni.
Per approfondire il problema, I ricercatori del PNNL hanno combinato diversi strumenti in un modo nuovo. Hanno inviato fasci d'acqua a varie velocità su ossido di titanio freddo seduto sotto un microscopio ad altissima risoluzione noto come microscopio a effetto tunnel.
Il microscopio ha permesso loro di visualizzare gli atomi di titanio e ossigeno del catalizzatore. Gli atomi appaiono come righe luminose e scure, come un campo di grano con alti filari di grano alternati a fossi, e le singole molecole d'acqua appaiono come punti luminosi che non si allineano con le file.
Oltre a vedere le molecole d'acqua mentre colpiscono la superficie, il team ha simulato i dettagli degli atomi che interagiscono nei minimi dettagli su un computer ad alte prestazioni. La combinazione di esperimenti e simulazioni ha permesso al team di risolvere il dibattito di lunga data.
Attrazione istantanea
A forma di V, una molecola d'acqua ha un atomo di ossigeno grasso nel mezzo legato a due atomi di idrogeno più piccoli su entrambi i lati. L'ossido di titanio aiuta a rompere i legami tra gli atomi per spingere in avanti una reazione chimica:gli atomi di titanio intrappolano le molecole d'acqua, mentre gli ossigeni vicini, anche parte della superficie del catalizzatore, si allontana e poi cattura uno degli atomi di idrogeno.
Quando questo accade, si formano due ossidrili, uno da un ossigeno superficiale che si combina con l'idrogeno e l'altro rimasto dalla molecola d'acqua.
Gli scienziati avevano bisogno di sapere con quale frequenza si formavano gli idrossili. Le molecole d'acqua rimangono in gran parte intatte sulla superficie? O si convertono immediatamente in idrossili? La probabilità che l'acqua rimanga intatta sull'ossido di titanio e la facilità con cui gli idrossili si riformano in acqua pone le basi per altre reazioni chimiche.
Per scoprirlo, i chimici hanno dovuto sviluppare tecnologie per misurare la frequenza con cui gli idrossili si sono formati sulla superficie. Utilizzando le risorse sviluppate all'interno di EMSL, il Laboratorio di Scienze Molecolari Ambientali, un DOE Office of Science User Facility presso PNNL, hanno sparato un raggio di molecole d'acqua su una superficie di ossido di titanio a bassa energia, il raggio che spara lentamente, e ad alta energia, muovendosi velocemente come su una manichetta antincendio.
Sono finiti con punti luminosi sulla superficie, e maggiore è l'energia, più punti. Ma le macchie non sembravano abbastanza luminose da includere entrambi gli idrossili, come previsto, quindi hanno eseguito ulteriori esperimenti per determinare quali fossero le macchie.
azzeccato
Il team ha sparato dell'acqua sulla superficie del biossido di titanio e poi l'ha congelata sul posto. Poi hanno scaldato lentamente il tutto. L'aumento della temperatura ha rivelato le macchie, che pensavano fossero almeno un idrossile, che si trasformavano in molecole d'acqua. Ciò significava che ogni punto doveva essere effettivamente una coppia di idrossili perché le prove mostravano che tutte le materie prime necessarie per creare una molecola d'acqua erano lì, ed erano necessari entrambi gli ossidrili.
Hanno eseguito vari altri esperimenti per determinare la temperatura alla quale una molecola di acqua di atterraggio si converte in coppie di ossidrili e viceversa. Da ciò hanno appreso che l'acqua è solo leggermente più stabile delle coppie di ossidrili sulla superficie, il 10% in più, se consideriamo la quantità di energia necessaria per interromperli.
Simulazione degli atterraggi in acqua su un computer ad alte prestazioni, anche all'EMSL, i ricercatori hanno scoperto che le uniche molecole d'acqua che si sono attaccate al catalizzatore erano quelle che sono atterrate in un fosso figurato all'interno di un campo di grano, dove l'ossigeno dell'acqua si trovava di fronte a un atomo di titanio nel fosso.
Se l'acqua arrivasse alla giusta velocità, l'acqua si riorientò e attraccò uno dei suoi idrogeni verso un vicino ossigeno, formando le coppie di ossidrili viste negli esperimenti. Altrimenti, la molecola d'acqua è appena rimbalzata.
"Abbiamo scoperto che l'elettrostatica, la stessa statica che fa scintille quando strofini i piedi sul tappeto, aiuta a guidare le molecole d'acqua sulla superficie, " ha detto il chimico teorico e coautore Roger Rousseau.
Tutti questi dettagli aiuteranno i ricercatori a comprendere meglio la catalisi e a migliorare la nostra comprensione delle reazioni chimiche. Inoltre, i risultati rivelano un valore che gli scienziati hanno cercato a lungo di inchiodare:quanto sia facile o difficile per l'acqua perdere un idrogeno sull'ossido di titanio.