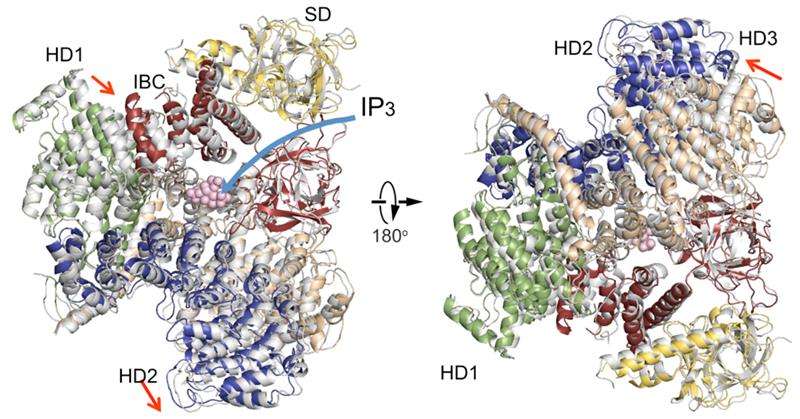
Un confronto delle strutture del dominio citosolico IP3R in assenza di IP3 (colorato) con uno in presenza di IP3 (grigio). Organizzazione del dominio. Dominio soppressore (SD), giallo; Nucleo di associazione IP3 (IBC), rosso; dominio elicoidale 1 (HD1), verde; dominio elicoidale 2 (HD2), blu; dominio elicoidale 3, Grano. Attestazione:RIKEN
I ricercatori del RIKEN Brain Science Institute hanno determinato la struttura di risoluzione atomica di una molecola chiave che traduce i segnali dall'ambiente locale di una cellula in un linguaggio che la cellula può comprendere e utilizzare. La determinazione dell'architettura del recettore dell'inositolo tris-fosfato (IP3R) è stata a lungo considerata un obiettivo importante nella ricerca biomedica a causa del suo ruolo strategico all'interno delle cellule come stazione ferroviaria molecolare per il trasferimento di segnali che controllano molte funzioni cellulari.
Culminando uno sforzo di quasi 10 anni, i ricercatori hanno determinato la struttura di risoluzione atomica di una molecola chiave che traduce i segnali dall'ambiente locale di una cellula in un linguaggio che la cellula può comprendere e utilizzare. La determinazione dell'architettura del recettore dell'inositolo tris-fosfato (IP3R) è stata a lungo considerata un obiettivo importante nella ricerca biomedica a causa del suo ruolo strategico all'interno delle cellule come stazione ferroviaria molecolare per il trasferimento di segnali che controllano molte funzioni cellulari. La struttura dovrebbe contribuire allo sviluppo di migliori approcci terapeutici per molte malattie. Il lavoro è stato condotto da un team del RIKEN Brain Science Institute sotto la direzione del professor Katsuhiko Mikoshiba, il cui laboratorio ha clonato il primo gene IP3R nel 1989.
In tutte le cellule viventi, i segnali chimici sono imbrigliati per la comunicazione intracellulare. L'inositolo 1, 4, Il 5-trifosfato (IP3) è uno di questi segnali che si lega al recettore IP3 (IP3R) per rilasciare ioni calcio (Ca2+) dai depositi di Ca2+ intracellulari come il reticolo endoplasmatico. I depositi di Ca2+ incorporati nell'IP3R sono distribuiti in vari microdomini all'interno delle cellule e hanno ruoli fondamentali in processi diversi come la comunicazione neurale, differenziazione, plasticità, e metabolismo. Dei tre geni identificati, l'IP3R di tipo 1 dominante cerebrale (IP3R1) è geneticamente causale dell'atassia spinocerebellare 15/16/29 e della sindrome di Gillespie, e regola i processi di smaltimento dei rifiuti cellulari implicati nell'eziologia delle malattie neurodegenerative compreso il morbo di Alzheimer. Sebbene gli importanti ruoli di IP3R in condizioni normali e patologiche siano ben noti, capire come i segnali IP3 inneschino l'apertura del canale Ca2+ era elusivo.
La nuova struttura cristallina IP3R1 rivela un ricco cosmo di dettagli su scala atomica sulla sua funzione. IP3R1 è una micromacchina di 20 nm di diametro che contiene due sottostrutture funzionali, un sito di legame IP3 e un poro del canale Ca2+. La distanza dal sito di legame IP3 al poro del canale è 7 nm, il più lungo tra i canali ionici simili, e la domanda fondamentale su come il legame IP3 apra fisicamente il canale da un lungo raggio è rimasta senza risposta nei decenni da quando il gene è stato clonato. Cristallografia a raggi X del grande dominio citosolico di un topo IP3R1 in assenza e presenza di IP3, presso la fabbrica di fasci di ioni RIKEN SPring-8, ha individuato un meccanismo a lungo raggio che coinvolge un movimento globale dipendente da IP3 di una parte del recettore chiamato dominio α-elicoidale di curvatura che funge da ponte tra i domini citosolico e canale. La mutagenesi di questo ponte ha rivelato il ruolo essenziale di una struttura a lembi nel dominio α-elicoidale che trasmette i segnali IP3 al canale, e può aiutare a spiegare come avviene l'accoppiamento a lungo raggio dal legame IP3 al canale Ca2+.
I risultati rivelano somiglianze e differenze con un rapporto pubblicato di recente sull'IP3R utilizzando un metodo completamente diverso chiamato microscopia crioelettronica. Nel relativo studio, un gruppo guidato da Irina Serysheva dell'Università del Texas Health Science Center di Houston ha proposto che l'attivazione del canale da parte di IP3 possa avvenire tramite il legame diretto del dominio C-terminale e IP3 e l'accoppiamento dal dominio di legame IP3 alle subunità vicine. I dati attuali non sono d'accordo con queste conclusioni, suggerendo invece che il sito di legame di IP3 alla regione dei lembi è alla base dei cambiamenti strutturali dinamici di IP3. Un confronto delle due strutture rivela un accordo su una parte immobile del dominio elicoidale di curvatura e una disposizione variabile di altri domini elicoidali. Gli autori ipotizzano che la sezione immobile agirebbe come un corpo rigido che conduce un momento torcente dai siti di legame IP3 al dominio del canale, considerando che le regioni flessibili contribuirebbero alle proprietà dinamiche della funzione IP3R.
Risolvere il mistero di lunga data della comunicazione a lungo raggio che consente all'IP3 di aprire il canale aiuterà la futura progettazione razionale di farmaci mirati al recettore che potrebbe consentire una gamma più diversificata di vie terapeutiche. I risultati possono anche chiarire i ruoli di IP3R nella senescenza cellulare e nella soppressione del tumore legati alla vulnerabilità selettiva delle cellule tumorali. Sorprendentemente, lo studio chiarisce anche un ruolo degli IP3R nella funzione di organismi unicellulari patogeni come Trypanosoma cruzi, il parassita della malattia di Chagas, e bruce, che causa tripanosomiasi africana o malattia del sonno. Il team ha identificato una sequenza di amminoacidi nel foglietto che è conservata nei parassiti, suggerendo intuizioni strutturali che possono aiutare nella scoperta di farmaci per queste condizioni devastanti.