Figura 1. La struttura a nastro del complesso del fotosistema II (ID PDB:3ARC). Credito:Università di Kobe
La fotosintesi richiede un meccanismo per produrre grandi quantità di energia chimica senza perdere il potere ossidativo necessario per scomporre l'acqua. Un gruppo di ricerca giapponese ha chiarito parte di questo meccanismo, segnando un altro passo verso il potenziale sviluppo della fotosintesi artificiale. I risultati sono stati pubblicati il 27 febbraio nell'edizione online del Journal of Physical Chemistry Letters .
Il team è stato guidato dal professor KOBORI Yasuhiro (Centro di ricerca sulla fotoscienza molecolare dell'Università di Kobe) e dallo studente di dottorato HASEGAWA Masashi (Scuola di specializzazione in scienze) con il professore associato MINO Hiroyuki (Scuola di specializzazione in scienze dell'Università di Nagoya).
Durante la reazione di scissione dell'acqua nella fotosintesi, le piante producono ossigeno convertendo l'energia solare in energia chimica, fornendo la fonte di energia necessaria per la loro sopravvivenza. Questa reazione è condotta da un complesso proteico nei cloroplasti (che si trova nelle foglie) chiamato complesso del fotosistema II (vedi figura 1).
Nel 2015 il team di ricerca del professor Kobori è riuscito ad analizzare le interazioni elettroniche e il posizionamento tridimensionale della separazione di carica iniziale prodotta direttamente dopo la fotoreazione nel centro di reazione fotosintetica dei batteri viola, che non causano il potenziale di ossidazione per la scissione dell'acqua. Però, nel complesso del fotosistema II per le piante superiori, la configurazione dello stato iniziale di separazione della carica non era chiara, ed era un mistero come portasse a un'efficace reazione di scissione dell'acqua pur mantenendo l'alto potere ossidativo.
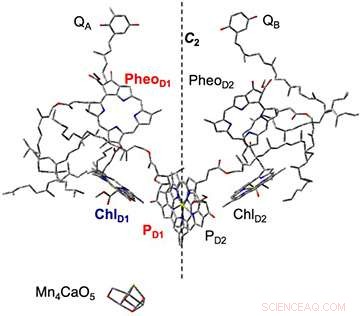
Figura 2. La composizione delle molecole di pigmento al centro della reazione complessa del fotosistema II, chiarito dall'analisi strutturale a raggi X. Sulla base del processo di separazione della carica iniziale, una carica negativa si verifica nella feofitina (PheoD1) e una carica positiva nella clorofilla (PD1). Questa volta plastochinone (QA, QB) è stato pre-ridotto:i campioni di membrana tilacoide in cui era stato sospeso il trasferimento di elettroni dalla feofitina sono stati irradiati, e lo stato di separazione della carica (PheoD1-・ PD1+・) è stato catturato. Mn4CaO5 viene ossidato da PD1+・ e funge da catalizzatore per la scissione dell'acqua. Credito:Università di Kobe
Gli scienziati hanno estratto le membrane tilacoidi (dove avviene la fotoreazione nella fotosintesi) dagli spinaci, aggiunto un agente riducente, e irradiato i campioni. Ciò ha permesso loro di rilevare i segnali a microonde dallo stato iniziale di separazione della carica con un grado di precisione di 10 milionesimi di secondo (vedi figura 3a). Hanno sviluppato un metodo per analizzare i segnali a microonde utilizzando l'imaging con polarizzazione di spin. Per la prima volta è stato possibile effettuare un'analisi in vista 3D della configurazione della carica elettrica prodotta direttamente dopo l'esposizione alla luce come intermedio reattivo. Questo è stato fatto con una precisione entro 10 milionesimo di secondo, come fotografia consecutiva (vedi figura 3b). Sulla base di questa visualizzazione, hanno anche quantificato l'interazione elettronica che si verifica quando le orbite degli elettroni si sovrappongono per molecole con cariche elettriche (figura 3c).
La struttura iniziale di separazione della carica elettrica chiarita da questa analisi non era molto diversa dalla struttura prima della reazione, ma l'analisi delle immagini ha mostrato che la carica elettrica positiva che si è verificata nel pigmento come intermedio reattivo esisteva in modo sproporzionato nelle singole molecole di clorofilla (figura 3b, C). Suggerisce che c'è una forte stabilizzazione causata dall'interazione elettrostatica tra le cariche.
È stato rivelato che il ritorno della carica negativa è soppresso, poiché la sovrapposizione tra le orbite degli elettroni è fortemente limitata dall'effetto isolante del capolinea del gruppo vinilico. Ciò significa che diventa possibile utilizzare gli elevati poteri ossidanti della carica positiva in clorofilla (PD1) per la successiva decomposizione ossidativa dell'acqua.
Sulla base di questi risultati, i ricercatori hanno sbloccato parte del meccanismo per produrre efficacemente elevate quantità di energia chimica senza perdita del potere ossidativo necessario per scindere l'acqua nella fotosintesi. Questi risultati potrebbero aiutare a progettare un "sistema di fotosintesi artificiale" in grado di fornire una fonte di energia pulita convertendo in modo efficiente l'energia solare in grandi quantità di elettricità e idrogeno. L'applicazione di questo principio potrebbe contribuire a risolvere i problemi con l'energia, l'ambiente e la scarsità di cibo.
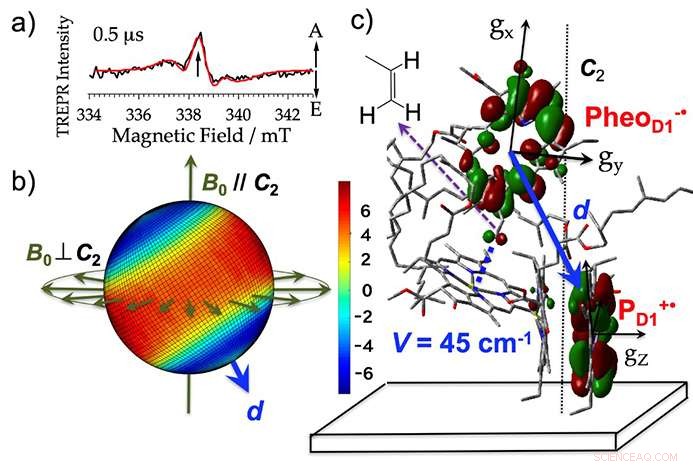
Figura 3. a) Lo spettro per il complesso del fotosistema II ottenuto utilizzando la risonanza paramagnetica elettronica risolta nel tempo (TREPR). A ed E mostrano i segnali a microonde per l'assorbimento e l'emissione (polarizzazione di spin elettronico). b) L'imaging 3D di (a) la polarizzazione dello spin dell'elettrone mappata su tutte le possibili direzioni del campo magnetico a un'intensità del campo magnetico di risonanza di 338,3 mT. Il rosso e il blu visualizzano rispettivamente l'intensità di assorbimento e di emissione del microonde. Per i campioni in cui il film è allineato con l'asse della membrana tilacoide, il segnale cambia quando la direzione del campo magnetico esterno (B0) rispetto alla direzione normale del piano del film (C2) è parallela (B0//C2) e perpendicolare (B0⊥C2) supporta questa immagine tridimensionale. d mostra il vettore direzionale che collega le cariche elettriche. c) Il posizionamento orbitale dello stato iniziale di separazione della carica elettrica (PheoD1-・PD1+・) nel centro di reazione. Credito:Università di Kobe