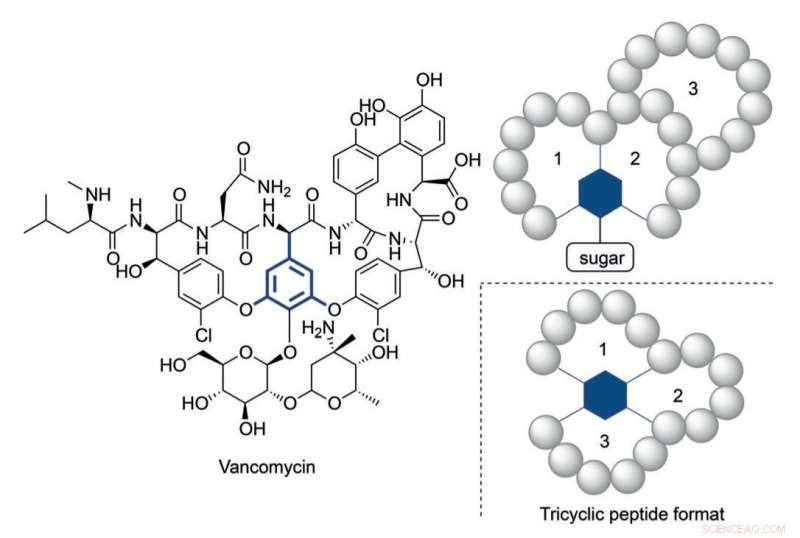
Struttura della vancomicina e un formato di peptidi triciclici ispirato alla sua struttura multiciclica. Credito:HIMS
I chimici del Van 't Hoff Institute for Molecular Sciences (HIMS) e Pepscan (Lelystad) dell'Università di Amsterdam hanno sviluppato una nuova metodologia per bloccare i peptidi lineari in strutture tricicliche altamente rigide con potenziale farmaceutico. I loro risultati sono stati appena riportati in Angewandte Chemie .
La metodologia, sviluppato da HIMS Ph.D. studente Gaston Richelle, consente la sintesi parallela di più peptidi triciclici in un formato di libreria. Ciò consente il successivo screening biologico al fine di identificare nuove terapie peptidiche.
Maggiore livello di complessità strutturale
Nell'ultimo decennio i peptidi ciclici sono emersi come una promettente classe di terapie, mostrando un'ampia finestra terapeutica che spazia dall'antifertilità alle applicazioni antivirali e antitumorali. Sono stati identificati molti peptidi monociclici e biciclici e il numero di peptidi ciclici che entrano negli studi clinici è drasticamente aumentato.
Comunque, è diventato chiaro che in alcuni casi sono necessari peptidi strutturalmente più complessi per raggiungere livelli di attività appropriati. vancomicina, il peptide antibiotico triciclico di ultima istanza, fornisce un esempio illustrativo di un costrutto così complesso. L'allarmante aumento della resistenza dei batteri contro gli antibiotici attualmente disponibili richiede complessi costrutti peptidici in analogia alla vancomicina.
Credito:HIMS
La ricerca di nuove vie sintetiche per complessi peptidi multiciclici ha quindi riscosso un serio interesse. Le metodologie precedentemente riportate per la creazione di peptidi multiciclici sono state limitate a causa della formazione di più isomeri, protocolli di reazione laboriosi o diversità strutturale limitata.
CLIP combinate con CuAAC
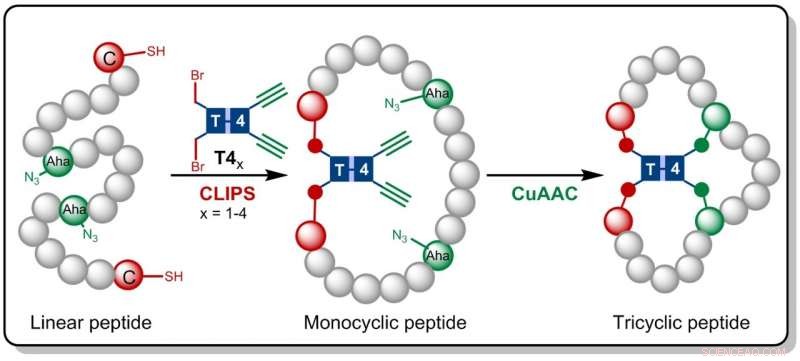
Nella ricerca ora pubblicata in Angewandte Chemie , i chimici di Amsterdam si basano sulla tecnologia CLIPS sviluppata in precedenza presso Pepscan. Questo metodo per il "collegamento chimico di peptidi sugli scaffold" produce peptidi monociclici e biciclici che hanno dimostrato di mostrare selettività e affinità migliorate contro le proteine bersaglio.
Gaston Richelle ha ora combinato il metodo CLIPS con la chimica "click" CuAAC completamente compatibile, che porta alla formazione dei complessi peptidi triciclici. Facendo uso di molecole di scaffold flessibili, i ricercati peptidi triciclici sono formati in modo isomericamente puro. Il vantaggio principale della nuova metodologia è che le reazioni CLIPS e CuAAC possono essere eseguite in una procedura one-pot senza limitazioni alla natura e alle quantità di amminoacidi implementati nei loop peptidici.
Di conseguenza, la metodologia può essere applicata in librerie di peptidi ad alta diversità per generare un'ampia gamma di topologie tricicliche che possono essere esaminate per l'attività biologica. Attualmente vengono effettuati screening multipli di inibizione, per esempio. contro gli enzimi che sono molto abbondanti nelle cellule tumorali di primo stadio. Vengono inoltre condotti nuovi studi sull'attività antimicrobica contro MRSA e Staphylococcus aureus. Aggiungendo a questo, il team di ricerca sta attualmente studiando l'uso di scaffold T6 ancora più complessi per creare peptidi penta ed esaciclici.