
Il postdoc del MIT Sulata Sahu (a sinistra) e lo studente laureato Brian Chmielowiec tengono un campione di rame quasi puro depositato su un elettrodo di ferro. Credito:Denis Paiste/Centro di elaborazione dei materiali
I ricercatori del MIT hanno identificato la temperatura corretta e la miscela chimica per separare selettivamente il rame puro e altri oligoelementi metallici dai minerali a base di zolfo utilizzando l'elettrolisi fusa. Questo passo, processo ecologico semplifica la produzione di metallo ed elimina i sottoprodotti tossici come l'anidride solforosa.
Il postdoc Sulata K. Sahu e il dottorando Brian J. Chmielowiec '12 hanno decomposto minerali ricchi di zolfo in zolfo puro ed estratto tre diversi metalli ad altissima purezza:rame, molibdeno, e renio. Hanno anche quantificato la quantità di energia necessaria per eseguire il processo di estrazione.
Una cella di elettrolisi è un circuito chiuso, come una batteria, ma invece di produrre energia elettrica, consuma energia elettrica per scomporre i composti nei loro elementi, Per esempio, scindere l'acqua in idrogeno e ossigeno. Tali processi elettrolitici sono il metodo principale di produzione dell'alluminio e vengono utilizzati come passaggio finale per rimuovere le impurità nella produzione del rame. Contrariamente all'alluminio, però, non ci sono processi diretti di decomposizione elettrolitica per i minerali di solfuro contenenti rame per produrre rame liquido.
I ricercatori del MIT hanno trovato un metodo promettente per formare rame metallico liquido e gas di zolfo nella loro cella da un elettrolita composto da solfuro di bario, solfuro di lantanio, e solfuro di rame, che produce più del 99,9% di rame puro. Questa purezza è equivalente ai migliori metodi di produzione del rame attuali. I loro risultati sono pubblicati in un documento di Electrochimica Acta con l'autore senior Antoine Allanore, assistente professore di metallurgia.
Processo in un solo passaggio
"Si tratta di un processo in un unico passaggio, direttamente basta decomporre il solfuro in rame e zolfo. Altri metodi precedenti sono più passaggi, " Sahu spiega. "Adottando questo processo, puntiamo a ridurre i costi".
Il rame è sempre più richiesto per l'uso nei veicoli elettrici, energia solare, elettronica di consumo e altri obiettivi di efficienza energetica. La maggior parte degli attuali processi di estrazione del rame bruciano i minerali di solfuro nell'aria, che produce anidride solforosa, un inquinante atmosferico nocivo che deve essere catturato e ritrattato, ma il nuovo metodo produce zolfo elementare, che può essere tranquillamente riutilizzato, Per esempio, nei fertilizzanti. I ricercatori hanno anche usato l'elettrolisi per produrre renio e molibdeno, che si trovano spesso nei solfuri di rame a livelli molto piccoli.
Il nuovo lavoro si basa su un articolo del Journal of The Electrochemical Society del 2016 che offre la prova dell'estrazione elettrolitica del rame, scritto da Samira Sokhanvaran, Sang-Kwon Lee, Guillaume Lambotte, e Allanore. Hanno dimostrato che l'aggiunta di solfuro di bario a una fusione di solfuro di rame sopprimeva la conduttività elettrica del solfuro di rame abbastanza da estrarre una piccola quantità di rame puro dalla cella elettrochimica ad alta temperatura operante a 1, 105 gradi Celsius (2, 021 Fahrenheit). Sokhanvaran è ora ricercatore presso Natural Resources Canada-Canmet Mining; Lee è un ricercatore senior presso il Korea Atomic Energy Research Institute; e Lambotte è ora un ingegnere di ricerca senior presso la Boston Electrometallurgical Corp.
"Questo documento è stato il primo a dimostrare che è possibile utilizzare una miscela in cui presumibilmente la conduttività elettronica domina la conduzione, ma in realtà non c'è il 100%. C'è una piccola frazione che è ionica, che è abbastanza buono per fare il rame, "Spiega Allanore.
"Il nuovo documento mostra che possiamo andare oltre e renderlo quasi completamente ionico, cioè ridurre la quota di conducibilità elettronica e quindi aumentare l'efficienza per fare il metallo, "dice Allanore.
Questi minerali di solfuro sono composti in cui il metallo e gli elementi di zolfo condividono gli elettroni. Nel loro stato fuso, agli ioni di rame manca un elettrone, dando loro una carica positiva, mentre gli ioni di zolfo trasportano due elettroni in più, dando loro una carica negativa. La reazione desiderata in una cella di elettrolisi è quella di formare atomi elementari, aggiungendo elettroni a metalli come il rame, e sottraendo elettroni allo zolfo. Ciò accade quando gli elettroni extra vengono introdotti nel sistema dalla tensione applicata. Gli ioni metallici reagiscono al catodo, un elettrodo caricato negativamente, dove acquisiscono elettroni in un processo chiamato riduzione; nel frattempo, gli ioni di zolfo carichi negativamente stanno reagendo all'anodo, un elettrodo caricato positivamente, dove cedono gli elettroni in un processo chiamato ossidazione.
In una cella che utilizzava solo solfuro di rame, Per esempio, a causa della sua elevata conducibilità elettronica, gli elettroni extra fluirebbero semplicemente attraverso l'elettrolita senza interagire con i singoli ioni di rame e zolfo agli elettrodi e non si verificherebbe alcuna separazione. I ricercatori del Gruppo Allanore hanno identificato con successo altri composti solforati che, quando aggiunto al solfuro di rame, modificare il comportamento del fuso in modo che gli ioni, piuttosto che gli elettroni, diventano i principali portatori di carica attraverso il sistema e quindi consentono le reazioni chimiche desiderate. Parlando tecnicamente, gli additivi aumentano il bandgap del solfuro di rame in modo che non sia più elettronicamente conduttivo, Chmielowiec spiega. La frazione degli elettroni impegnati nelle reazioni di ossidazione e riduzione, misurata come percentuale della corrente totale, questo è il flusso totale di elettroni nella cella, prende il nome di efficienza faradaica.
Raddoppia l'efficienza
Il nuovo lavoro raddoppia l'efficienza per l'estrazione elettrolitica del rame riportata nel primo articolo, che era del 28% con un elettrolita in cui solo solfuro di bario aggiunto al solfuro di rame, al 59% nella seconda carta con solfuro di lantanio e solfuro di bario aggiunti al solfuro di rame.
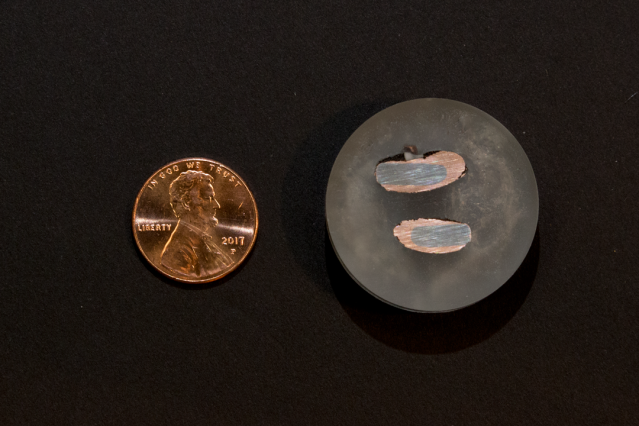
Un nuovo centesimo, a sinistra, contrasta con campioni di rame quasi puro depositati su un elettrodo di ferro dopo l'estrazione attraverso un processo elettrochimico. Credito:Denis Paiste/Centro di elaborazione dei materiali
"Dimostrare che possiamo eseguire reazioni faradaiche in un solfuro di metallo liquido è nuovo e può aprire la porta allo studio di molti sistemi diversi, " Dice Chmielowiec. "Funziona per qualcosa di più del semplice rame. Siamo stati in grado di produrre renio, e siamo stati in grado di produrre molibdeno." Il renio e il molibdeno sono metalli importanti a livello industriale che trovano impiego nei motori degli aerei a reazione, Per esempio. Il laboratorio Allanore ha utilizzato anche l'elettrolisi fusa per produrre zinco, stagno e argento, ma guida, nichel e altri metalli sono possibili, egli propone.
La quantità di energia richiesta per eseguire il processo di separazione in una cella di elettrolisi è proporzionale all'efficienza faradica e alla tensione della cella. Per l'acqua, che è stato uno dei primi composti ad essere separato per elettrolisi, la tensione minima della cella, o energia di decomposizione, è 1,23 volt. Sahu e Chmielowiec hanno identificato le tensioni delle celle nella loro cella come 0,06 volt per il solfuro di renio, 0,33 volt per solfuro di molibdeno, e 0,45 volt per solfuro di rame. "Per la maggior parte delle nostre reazioni, applichiamo 0,5 o 0,6 volt, in modo che i tre solfuri siano ridotti insieme a metallici, renio, molibdeno e rame, " Spiega Sahu. Alla temperatura di esercizio della cella e a un potenziale applicato da 0,5 a 0,6 volt, il sistema preferisce decomporre quei metalli perché l'energia richiesta per decomporre sia il solfuro di lantanio, circa 1,7 volt, sia il solfuro di bario, circa 1,9 volt, è relativamente molto più alta. Esperimenti separati hanno anche dimostrato la capacità di ridurre selettivamente il renio o il molibdeno senza ridurre il rame, in base alle loro diverse energie di decomposizione.
Potenziale industriale
Importanti metalli strategici e di base tra cui, rame, zinco, guida, renio, e molibdeno si trovano tipicamente nei minerali di solfuro e meno comunemente nei minerali a base di ossido, come nel caso dell'alluminio. "Ciò che si fa in genere è bruciarli nell'aria per rimuovere lo zolfo, ma così facendo si produce SO2 [anidride solforosa], e nessuno è autorizzato a rilasciarlo direttamente nell'aria, quindi devono catturarlo in qualche modo. Ci sono molti costi di capitale associati alla cattura di SO2 e alla sua conversione in acido solforico, " spiega Chmielowiec.
Il processo industriale più vicino all'estrazione elettrolitica del rame che sperano di vedere è la produzione di alluminio mediante un processo elettrolitico noto come processo di Hall-Héroult, che produce un pool di metallo di alluminio fuso che può essere continuamente sfruttato. "L'ideale è eseguire un processo continuo, " dice Chmielowiec. "Allora, nel nostro caso, si manterrebbe un livello costante di rame liquido e poi lo si toglie periodicamente dalla cella di elettrolisi. È stata dedicata molta ingegneria per l'industria dell'alluminio, quindi speriamo di cavarcela sulle spalle".
Sahu e Chmielowiec hanno condotto i loro esperimenti a 1, 227 C, circa 150 gradi Celsius sopra il punto di fusione del rame. È la temperatura comunemente usata nell'industria per l'estrazione del rame.
Ulteriori miglioramenti
I sistemi di elettrolisi dell'alluminio funzionano con un'efficienza faradica del 95%, quindi c'è spazio per miglioramenti dall'efficienza del 59% riportata dai ricercatori. Per migliorare la loro efficienza cellulare, Sahu dice, potrebbe essere necessario modificare il design della cella per recuperare una maggiore quantità di rame liquido. L'elettrolita può anche essere ulteriormente sintonizzato, aggiunta di solfuri diversi dal solfuro di bario e dal solfuro di lantanio. "Non esiste un'unica soluzione che ci permetterà di farlo. Sarà un'ottimizzazione per spostarlo su una scala più ampia, " dice Chmielowiec. Quel lavoro continua.
Sahu, 34, ha conseguito il dottorato di ricerca in chimica presso l'Università di Madras, in India. Chmielowiec, 27, uno studente di dottorato del secondo anno e un Salapatas Fellow in scienza e ingegneria dei materiali, ha conseguito la laurea in ingegneria chimica al MIT nel 2012 e un master in ingegneria chimica al Caltech nel 2014.
L'opera si inserisce nel lavoro del Gruppo Allanore sui materiali fusi ad alta temperatura, comprese le recenti scoperte nello sviluppo di nuove formule per prevedere la semiconduttività nei composti fusi e la dimostrazione di una cella termoelettrica fusa per produrre elettricità dal calore di scarto industriale. Il Gruppo Allanore è alla ricerca di un brevetto su alcuni aspetti del processo estrattivo.
Opera nuova e significativa
"Utilizzando un design intelligente della chimica di processo, questi ricercatori hanno sviluppato un percorso molto nuovo per la produzione di rame, "dice Rohan Akolkar, il F. Alex Nason Professore Associato di Ingegneria Chimica e Biomolecolare presso la Case Western Reserve University, che non era coinvolto in questo lavoro. "I ricercatori hanno progettato un processo che ha molti degli ingredienti chiave:è un detergente, scalabile, e un più semplice processo in un'unica fase per la produzione di rame dal minerale di solfuro."
"Tecnologicamente, gli autori apprezzano la necessità di rendere più efficiente il processo preservando la purezza intrinseca del rame prodotto, "dice Akolkar, che ha visitato il laboratorio Allanore alla fine dell'anno scorso. "Se la tecnologia viene ulteriormente sviluppata e la sua tecno-economia sembra favorevole, quindi può fornire un potenziale percorso per una produzione più semplice e pulita di rame metallico, che è importante per molte applicazioni." Akolkar osserva che "la qualità di questo lavoro è eccellente. Il gruppo di ricerca Allanore del MIT è in prima linea quando si tratta di far progredire la ricerca sull'elettrolisi dei sali fusi".
Jacob Jorné, professore di ingegneria chimica dell'Università di Rochester, afferma:"Gli attuali processi di estrazione comportano più passaggi e richiedono un elevato investimento di capitale, pertanto sono vietati miglioramenti costosi. Anche l'elettrolisi diretta dei minerali di solfuro metallico è vantaggiosa in quanto elimina la formazione di anidride solforosa, un inquinante delle piogge acide. "
"L'elettrochimica e la termodinamica nei sali fusi sono piuttosto diverse rispetto ai sistemi acquosi [a base d'acqua] e la ricerca di Allanore e del suo gruppo dimostra che molta buona chimica è stata ignorata in passato a causa della nostra devozione servile all'acqua, " suggerisce Jorné. "L'elettrolisi diretta dei minerali metallici apre la strada a un rinascimento metallurgico in cui nuove scoperte e processi possono essere implementati e possono modernizzare l'industria estrattiva obsoleta e migliorare la sua efficienza energetica. Il nuovo approccio può essere applicato ad altri metalli di grande importanza strategica come i metalli delle terre rare".
Questa storia è stata ripubblicata per gentile concessione di MIT News (web.mit.edu/newsoffice/), un popolare sito che copre notizie sulla ricerca del MIT, innovazione e didattica.