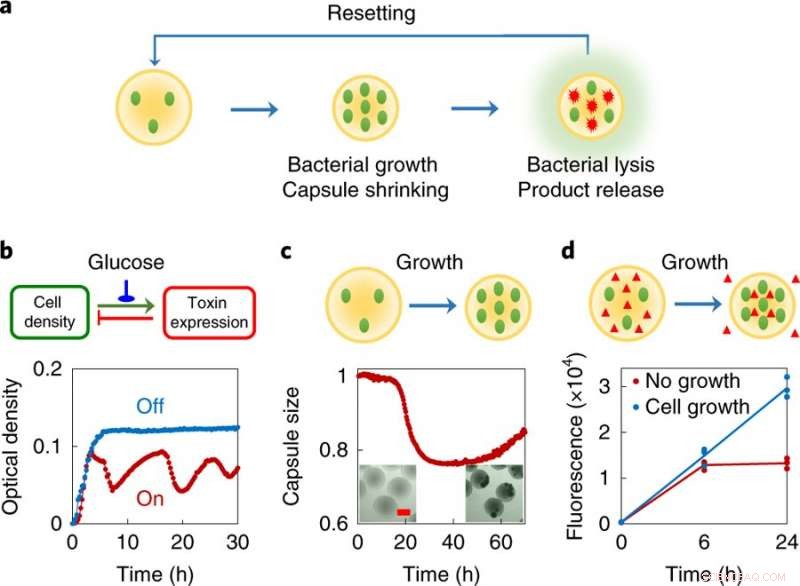
un, Idea di design, ogni swarmbot è costituito da una piccola popolazione di batteri ingegnerizzati incapsulati in microcapsule polimeriche. Questi batteri sono progettati per subire una lisi parziale a una densità locale sufficientemente elevata. Al contrario, il materiale incapsulante si ridurrà in risposta al cambiamento dell'ambiente chimico causato dalla crescita cellulare. Poiché i batteri subiscono un'autolisi programmata, rilasciano proteine intracellulari. Le capsule polimeriche reticolate intrappolano le cellule viventi e i grandi detriti all'interno, e il corrispondente restringimento facilita l'esportazione dei prodotti proteici dalle capsule. Il sistema viene ripristinato rabboccando con mezzo fresco. B, Lisi autonoma programmata dal circuito ePop (in alto, logica del circuito; parte inferiore, dati sperimentali). Un aumento dipendente dalla densità del numero di copie del plasmide porta ad un aumento dell'espressione di una tossina (la proteina E del fago φX174). Ad una concentrazione sufficientemente alta, la proteina E provoca la lisi cellulare, portando ad una diminuzione della densità cellulare. All'accensione (curva rossa), il circuito ha portato a una ridotta densità di coltura di MC4100Z1 (ePop) bilanciata dalla crescita e dall'uccisione regolata. Ai fini della progettazione complessiva del sistema, la generazione di oscillazioni non è essenziale. Il circuito può essere spento (curva blu) aggiungendo l'1% di glucosio. L'esperimento è stato ripetuto più di tre volte indipendentemente con risultati simili. C, Restringimento delle capsule in risposta alla crescita di batteri incapsulati (sopra, schematico; parte inferiore, dati sperimentali). Le cellule MC4100Z1 (ePop/GFP) sono state incapsulate in capsule di chitosano e coltivate in M9. Tutti i dati sono stati normalizzati al valore al tempo zero. inserto, immagini al microscopio di MSB dopo 0 h (sinistra) e 48 h (destra). Barra della scala, 200μm. L'esperimento è stato ripetuto più di tre volte indipendentemente con risultati simili. D, Il restringimento della capsula mediato dalla crescita facilita l'esportazione di macromolecole dalle capsule (parte superiore, schematico; parte inferiore, dati sperimentali). cellule MG1655 e destrano-rodamina (peso molecolare ≈ 70, 000 g mol−1) sono stati incapsulati nelle capsule di chitosano e coltivati in M9. Le capsule sono state trattate con o senza ampicillina (100 μg ml-1). Capsule restringenti, causata dalla crescita batterica in assenza di antibiotici, ha portato a un aumento di ~ 2,25 volte nella fluorescenza della rodamina rispetto alle capsule non restringenti dopo 24 h, che conteneva batteri non in crescita (soppressi dall'antibiotico). L'esperimento è stato fatto in triplicato come repliche biologiche indipendenti e i dati sono mostrati come punti individuali, la linea indica la media. Credito: Natura chimica biologia (2019). DOI:10.1038/s41589-019-0357-8
Gli ingegneri biomedici della Duke University hanno sviluppato una nuova piattaforma per creare farmaci biologici utilizzando batteri appositamente progettati che scoppiano e rilasciano proteine utili quando sentono che la loro capsula sta diventando troppo affollata.
La piattaforma si basa su due componenti principali:i batteri ingegnerizzati, chiamati "swarmbots, "che sono programmati per percepire la densità dei loro coetanei all'interno del loro contenitore, e il biomateriale che confina gli swarmbots, una capsula porosa che può ridursi in risposta ai cambiamenti nella popolazione batterica. Quando si restringe, la capsula spreme le proteine mirate create dai batteri in cattività.
Questa piattaforma autonoma potrebbe rendere più facile per i ricercatori creare, analizzare e purificare diversi prodotti biologici per l'uso nella bioproduzione su piccola scala.
La ricerca è apparsa online il 16 settembre sulla rivista Natura chimica biologia .
I batteri sono comunemente usati per produrre prodotti biologici, che sono prodotti come i vaccini, terapie geniche e proteine create o sintetizzate da fonti biologiche. Attualmente, questo processo prevede una serie di passaggi sofisticati tra cui la coltura cellulare, isolamento delle proteine e purificazione delle proteine, ognuna delle quali richiede infrastrutture delicate per garantire efficienza e qualità. Per le operazioni industriali, questi passaggi vengono eseguiti su larga scala. Mentre questo aiuta a produrre grandi quantità di determinate molecole, questa configurazione non è flessibile o finanziariamente sostenibile quando i ricercatori devono produrre piccole quantità di diversi prodotti biologici o lavorare in ambienti con risorse limitate.
La nuova tecnologia è stata sviluppata da Lingchong You, un professore di ingegneria biomedica alla Duke University, e un ex ricercatore post-dottorato Duke, Zhuojun Dai, ora professore associato presso l'Istituto di tecnologie avanzate di Shenzhen. Nel nuovo studio, mostrano come la loro nuova piattaforma utilizzi la comunicazione tra gli swarmbot e la loro capsula per ottenere una produzione versatile, analisi e purificazione di diverse proteine e complessi proteici.
In un precedente proof of concept, Tu e il suo team avete progettato un ceppo non patogeno di batteri E. coli per produrre un antidoto agli antibiotici quando i batteri hanno raggiunto una certa densità. Questi sciami sono stati poi confinati in una capsula, che è stato immerso in antibiotici. Se un batterio ha lasciato la capsula è stato distrutto, ma se rimaneva all'interno del container dove la densità di popolazione era alta, è sopravvissuto.
"Il nostro primo studio ha mostrato essenzialmente una comunicazione unidirezionale, dove le cellule potevano percepire l'ambiente all'interno della capsula ma l'ambiente non reagiva alle cellule, "dissi Tu. "Ora, abbiamo una comunicazione bidirezionale:gli sciami robot ingegnerizzati possono ancora percepire la loro densità e il loro confinamento, ma abbiamo introdotto un materiale che può rispondere quando la popolazione batterica al suo interno cambia. È come se i due componenti stessero parlando tra loro, e collettivamente ti danno un comportamento molto dinamico."
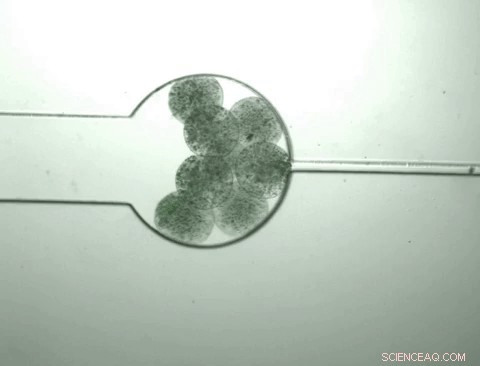
Capsule contenenti batteri su misura chiamati "swarmbots" crescono e si restringono in risposta all'ambiente chimico che contengono. Gli swarmbots sentono che la loro densità di popolazione ha raggiunto un certo livello e si aprono per rilasciare il loro contenuto, inclusa una proteina che sono stati progettati per produrre. La capsula quindi si restringe e il processo riprende quando vengono introdotti i nutrienti. Attestazione:Zhuojun Dai
Una volta che la popolazione all'interno della capsula raggiunge una certa densità, i batteri iniziano a scoppiare, ' rilasciando tutto il loro contenuto cellulare, compreso il prodotto proteico di interesse. Allo stesso tempo, questa crescita batterica cambia l'ambiente chimico all'interno della capsula, facendolo rimpicciolire. Mentre si restringe, spreme la proteina rilasciata dalle cellule che esplodono mentre i batteri e i detriti cellulari sono tenuti all'interno della capsula.
Una volta raccolte le proteine, i ricercatori possono aggiungere un rifornimento di nutrienti al piatto come spunto per l'ingrandimento delle capsule. Questo ripristina l'ambiente interno e consente ai batteri di ricominciare a crescere, riavviando il processo. Secondo te, questo ciclo può essere ripetuto fino a una settimana.
Per rendere l'approccio utile per la bioproduzione, il team ha aggiunto le capsule a un chip microfluidico, che includeva una camera per rilevare e quantificare quali proteine erano state rilasciate. Questo potrebbe essere sostituito con una camera di purificazione per preparare le proteine per l'uso in prodotti biologici.
"È un processo molto compatto. Non hai bisogno di elettricità, e non hai bisogno di una centrifuga per produrre e isolare queste proteine, " ha detto You. "Rende questa una buona piattaforma per la bioproduzione. Hai la possibilità di produrre un certo tipo di medicinale in un formato molto compatto a basso costo, ed è facile da consegnare. Oltre a ciò, questa piattaforma offre un modo semplice per produrre più proteine contemporaneamente".
Secondo te, questa facilità d'uso ha permesso al team di produrre, quantificare e purificare più di 50 proteine diverse in collaborazione con il laboratorio di Ashutoshi Chilkoti, Alan L. Kaganov Professore e Presidente del Dipartimento di Ingegneria Biomedica alla Duke. Hanno anche esplorato come la loro piattaforma può semplificare la creazione di complessi proteici, che sono strutture costituite da più proteine.
In un esperimento di prova per produrre un percorso di sintesi degli acidi grassi da più enzimi, "siamo stati in grado di utilizzare sette versioni dei nostri sciami microbici, ognuno dei quali è stato programmato per produrre un enzima diverso, " hai detto. "Di solito, per produrre un percorso metabolico avresti bisogno di bilanciare la catena di approvvigionamento, che potrebbe comportare la sovraregolazione dell'espressione di un enzima e la sottoregolazione dell'espressione di un altro. Con la nostra piattaforma non è necessario farlo, devi solo impostare il rapporto corretto di swarmbots."
"Questa tecnologia è incredibilmente versatile, " ha detto. "Questa è una capacità che vogliamo sfruttare."