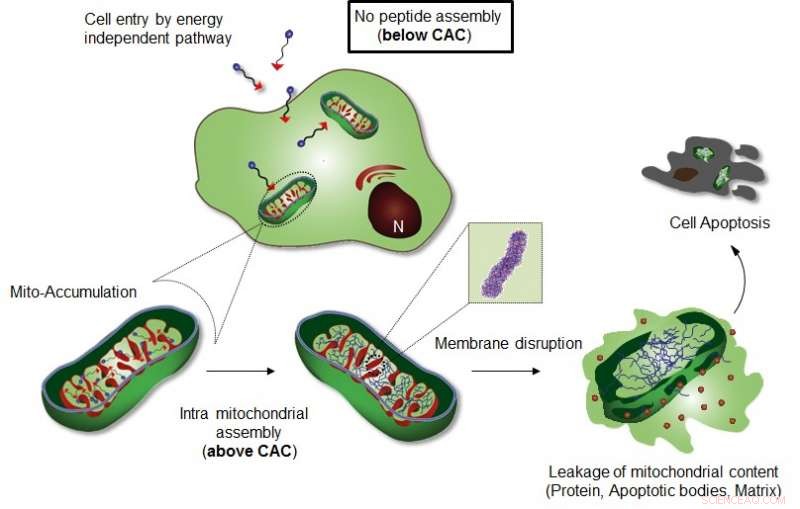
La figura mostra l'assemblaggio intra-mitocondriale di Mito-FF. Credito:UNIST
Assemblaggio in situ di peptidi anfifilici con funzioni cellulari di accompagnamento all'interno di una cellula vivente (cioè, assemblaggio intracellulare) e la loro interazione con i componenti cellulari stanno emergendo come una strategia versatile nel controllo del destino cellulare. Però, raggiungimento del controllo spazio-temporale (cioè, all'interno di organelli cellulari o altri sottocompartimenti) sull'autoassemblaggio di molecole sintetiche all'interno della cellula è impegnativo a causa della difficoltà di studiare i loro comportamenti nel complesso ambiente intracellulare.
Uno studio recente, affiliato con l'UNIST ha sviluppato un nuovo metodo per colpire i mitocondri di una cellula cancerosa. Il team di ricerca si aspetta che il loro studio possa aprire la strada a una nuova generazione di farmaci antitumorali.
Questa ricerca è stata condotta dal Professor Ja-Hyoung Ryu di Chimica presso l'UNIST in collaborazione con Sang Kyu Kwak di Ingegneria energetica e chimica presso l'UNIST e il Professor Eunji Lee della Graduate School of Analytical Science and Technology presso la Chungam National University. I risultati dello studio sono stati pubblicati nell'edizione del 21 aprile di Comunicazioni sulla natura.
Nello studio, il gruppo di ricerca congiunto ha introdotto, per la prima volta, l'autoassemblaggio localizzato negli organelli di un anfifilo peptidico come potente strategia per controllare il destino cellulare.
L'autoassemblaggio è un processo di equilibrio tra le singole unità immobiliari e il loro stato aggregato, e la concentrazione delle molecole dovrebbe essere superiore al valore critico per indurre l'assemblaggio (cioè, la concentrazione critica di aggregazione (CAC). Nelle cellule viventi, il raggiungimento del CAC è richiesto anche per formare assemblaggi di singole molecole, ma ha un limite perché la complessità chimica degli ambienti cellulari interrompe le interazioni tra le unità edilizie sintetiche.
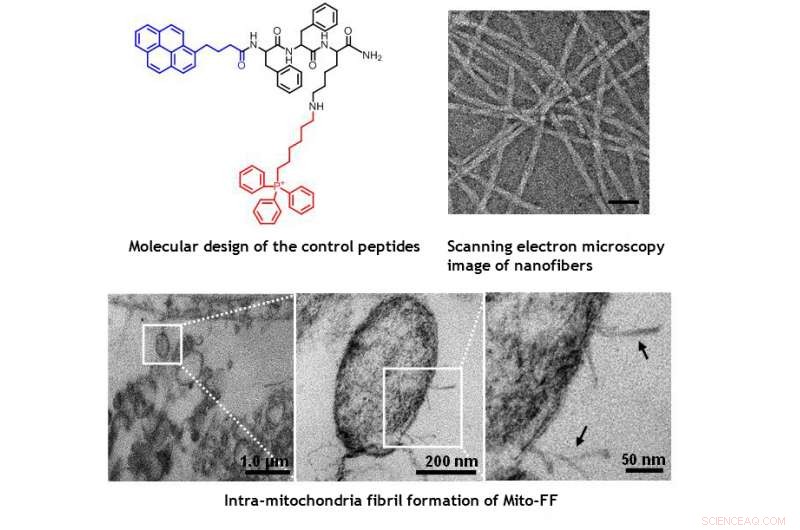
Immagini TEM dei mitocondri all'interno della cellula HeLa che mostrano il danno morfologico indotto da Mito-FF. Credito:UNIST
Autoassemblaggio intracellulare, così, richiede una maggiore concentrazione delle molecole rispetto al CAC, che possono limitare le implementazioni pratiche delle molecole autoassemblanti. Trasformazione della struttura molecolare da unità idrofile ad unità idrofobe all'interno della cellula (o spazio pericellulare) attraverso stimoli esterni (chimici, o fisico) è una potente strategia per ridurre il CAC aumentando la propensione all'autoassemblaggio. Però, stimoli chimici e fisici (es. leggero, temperatura, pH, e redox) non sono rilevanti per l'assemblaggio intracellulare perché inducono gravi danni alla cellula.
Il team di ricerca del professor Ryu ha introdotto uno specifico sistema di autoassemblaggio supramolecolare indotto dalla localizzazione di organelli cellulari (OLISA) che potrebbe essere una strategia generale per indurre l'autoassemblaggio aumentando le concentrazioni locali delle molecole autoassemblanti senza ulteriori trattamenti. Le piccole molecole si diffondono facilmente attraverso la membrana cellulare, raggiungere il sito bersaglio (organello o compartimento subcellulare a seconda della frazione bersaglio), e quindi subiscono l'autoassemblaggio all'interno dell'organello mirato a causa di una maggiore concentrazione locale. L'accumulo di molecole all'interno di un organello come i mitocondri è ~ 500-1, 000 volte superiore a quello dello spazio extracellulare.
"OLISA è una strategia più generale e diretta per raggiungere l'assemblaggio intracellulare ed è completamente nuova, è un approccio promettente per controllare il destino cellulare come l'apoptosi, proliferazione cellulare ecc. ed è una strategia utile per le loro indagini approfondite" afferma il professor Ryu.
Il design è costituito da peptide anfifilico che accumula i mitocondri (Mito-FF), che consiste di difenilalanina come blocco costitutivo che forma -foglio, TPP come frazione di targeting mitocondriale, e pirene come sonda fluorescente. Il mito-FF si è favorevolmente accumulato nei mitocondri delle cellule tumorali a causa dell'elevato potenziale di membrana negativo e dell'aumento della concentrazione che ha fatto sì che il mito-FF si autoassemblasse in una struttura fibrosa, considerando che la mancanza di formazione di fibrille è stata osservata nelle cellule normali. Le fibrille rigide Mito-FF hanno distrutto la membrana mitocondriale e attivato la via apoptotica intrinseca contro le cellule tumorali. Questo sistema OLISA offre un nuovo approccio per la chemioterapia antitumorale mirata.
M.T. Jeena di Chimica all'UNIST, l'autore principale dello studio si aspetta che il nuovo metodo getti le basi per una nuova serie di trattamenti che potrebbero massimizzare il processo di guarigione riducendo al minimo gli effetti collaterali.