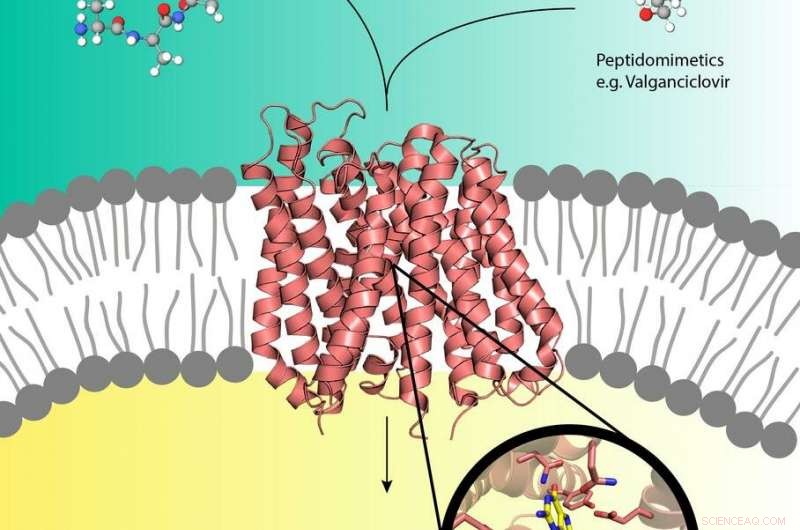
I pro-farmaci come il Valganciclovir (in alto a destra) possono utilizzare il trasportatore di peptidi (al centro) nella membrana cellulare che di solito trasporta i peptidi nutritivi (in alto a sinistra) nella cellula. Credito:EMBL, Yonca Ural-Blimke
Esperimenti presso la sorgente di raggi X PETRA III di DESY hanno rivelato la prima struttura di una proteina trasportatrice biologica caricata con un profarmaco. I profarmaci sono farmaci inattivi che vengono metabolizzati in un attivo, forma funzionale all'interno del corpo. Possono dirottare le proteine di trasporto dei nutrienti umani PepT1 o PepT2 che si trovano nella membrana cellulare e di solito incanalare nelle cellule i peptidi derivati dal cibo digerito. Per di qua, i pro-droghe possono fare l'autostop direttamente nella cella, accelerando l'assorbimento del farmaco. Mentre il concetto pro-droga è molto efficace, poco si sa a livello molecolare sulla struttura dei trasportatori peptidici e su come riconoscono, legare e trasportare i pro-droghe. I gruppi di Christian Loew e Jan Kosinski del Laboratorio europeo di biologia molecolare (EMBL) che lavorano presso il Centro per la biologia dei sistemi strutturali (CSSB) nel campus DESY di Amburgo sono ora un passo avanti verso la comprensione di ciò.
Gli scienziati hanno determinato la prima struttura cristallina ad alta risoluzione di un trasportatore di peptidi in complesso con il profarmaco farmacologico valganciclovir; un farmaco che combatte alcune infezioni virali. I loro risultati, pubblicato in Giornale della Società Chimica Americana , potrebbe aiutare nella progettazione di pro-farmaci con tassi di assorbimento migliorati. CSSB è una cooperazione di dieci istituzioni scientifiche tra cui DESY.
Il trasportatore di peptidi batterici DtpA di Escherichia coli è uno stretto omologo del trasportatore PepT1 umano ed è stato quindi scelto dagli scienziati come prototipo. La struttura spaziale di una biomolecola può essere determinata facendo crescere minuscoli cristalli da molte delle stesse biomolecole e illuminandoli con raggi X. I cristalli diffrangono i raggi X in un modo che è correlato alla loro struttura interna. Questo significa, dal modello di diffrazione, la struttura interna del cristallo può essere calcolata, rivelando la struttura atomica dei suoi costituenti, le biomolecole.
La crescita di cristalli di qualità sufficientemente elevata da biomolecole può essere molto impegnativa. Per produrre cristalli ben diffrangenti di DtpA, Loew ha collaborato con il gruppo di Jan Steyaert della Vrije Universiteit di Bruxelles per generare nanocorpi specifici per DtpA. I nanobodies sono frammenti di anticorpi specifici a dominio singolo. "Aumentano la stabilità delle proteine di membrana come il DtpA permettendoci così di generare cristalli di alta qualità, " spiega Loew.
Il gruppo di Loew ha quindi effettuato gli esperimenti di cristallizzazione di DtpA in complesso con un nanobody e una molecola pro-droga presso l'impianto di preparazione e caratterizzazione del campione (SPC) e ha analizzato i cristalli ottenuti alle linee di luce P13 e P14 che fanno parte dell'X- di DESY. sorgente luminosa a raggi PETRA III e gestita da t EMBL. Gli scienziati sono stati in grado di determinare una struttura di risoluzione di 2,65 Ångstrom (0,265 nanometri) di DtpA legata al profarmaco valganciclovir che ha rivelato una modalità di legame inaspettata. "L'orientamento del pro-farmaco nella tasca di rilegatura è capovolto di 180 gradi rispetto alle previsioni precedenti, " spiega Loew. "Abbiamo anche scoperto che DtpA si lega preferibilmente e probabilmente trasporta tripeptidi su dipeptidi".
Il gruppo Kosinski ha costruito un modello strutturale di alta qualità del trasportatore umano PepT1 in complesso con valganciclovir utilizzando la struttura cristallina DtpA come guida. "Il modello mostra che la PepT1 umana molto probabilmente lega il farmaco allo stesso modo del DtpA e individua gli esatti gruppi di amminoacidi responsabili del legame, " chiarisce Kosinski. Pertanto, le intuizioni generate da questo modello di PepT1 possono facilitare lo sviluppo di nuovi profarmaci con tassi di assorbimento migliorati. Tali miglioramenti non solo abbasserebbero la dose farmacologicamente efficace, ma potrebbero anche ridurre gli effetti collaterali negativi sperimentati dai pazienti.