Figura 1. Concetto di design di un nuovo formato di frammento di anticorpo "Fv-clasp". Fv-clasp è una semplice fusione del dominio SARAH derivato dalla proteina umana Mst1 al Fv (verde:catena pesante, ciano:catena leggera) frammento di un anticorpo. Il dimero VH/VL è stabilizzato dalla conformazione del dimero del dominio SARAH (magenta scuro e chiaro). Credito:Università di Osaka
Gli anticorpi sono un potente sistema di armi per difendere il nostro corpo dagli invasori come batteri e virus. Ogni anticorpo è costituito da quattro catene polipeptidiche di aminoacidi:due catene pesanti e due catene leggere unite per formare una molecola a forma di Y. Gli anticorpi riconoscono un antigene specifico unico per il suo bersaglio poiché possiedono i siti di legame dell'antigene situati sulle punte superiori della Y. Mentre le terapie basate sugli anticorpi sono state stabilite come farmaci di prima linea, sono stati fatti pochi progressi nell'uso degli anticorpi come strumenti di ricerca nella scoperta di farmaci a piccole molecole, in particolare nel campo della cristallografia a raggi X.
La cristallografia a raggi X è una tecnica che utilizza modelli di diffrazione dei raggi X per determinare l'alta risoluzione, strutture tridimensionali di molecole come proteine, piccole molecole organiche, e materiali. La principale sfida negli approcci di cristallografia a raggi X rimane la produzione di cristalli di diffrazione di alta qualità.
Negli ultimi anni, vi è un uso crescente di frammenti di anticorpo come chaperon di cristallizzazione per aiutare la determinazione strutturale di proteine bersaglio altrimenti "non cristallizzabili" o "non intaccabili". La base della strategia è aumentare la probabilità di ottenere cristalli ben ordinati minimizzando l'eterogeneità conformazionale nella proteina bersaglio.
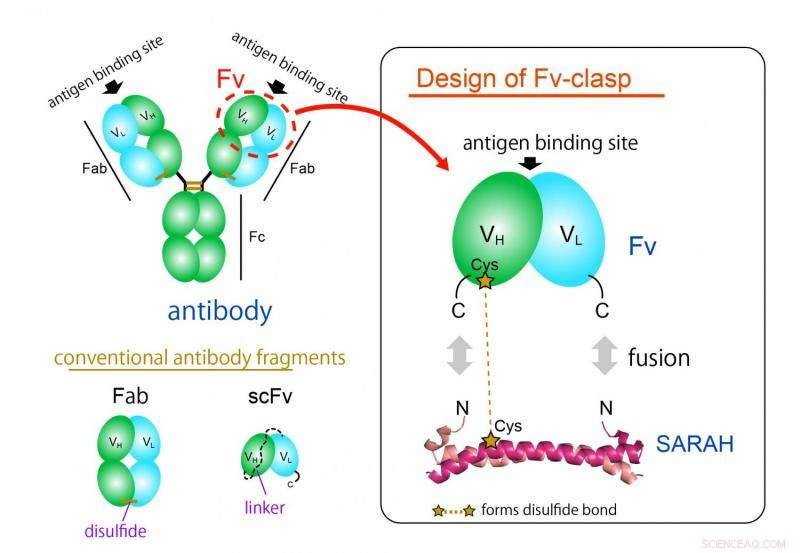
Il formato di frammento di anticorpo più comunemente usato è il formato Fab, ma è difficile da produrre nei sistemi di espressione batterica a causa della sua struttura ampia e complessa. Il frammento Fv dell'anticorpo, che contiene solo una catena pesante e una leggera, sarebbe l'ideale per questa applicazione grazie alla sua architettura semplice e piccola. Però, Fv è usato raramente perché le due catene si dissociano facilmente, portando a una perdita di funzionalità.

Figura 2. Struttura cristallina della chiusura Fv. Struttura tridimensionale effettiva della chiusura Fv determinata mediante analisi cristallografica a raggi X. Credito:Università di Osaka
Ora, un team di ricercatori dell'Università di Osaka ha progettato un nuovo frammento Fv a catena singola con una migliore compatibilità di produzione, stabilità e cristallizzabilità, mantenendo la capacità di legame della molecola originale. Hanno recentemente pubblicato i loro risultati su Structure.
"Abbiamo prodotto con successo un nuovo frammento fondendo una struttura a spirale antiparallela derivata da un particolare dominio di un enzima umano, Mst1 chinasi, ai siti di legame dell'antigene di un anticorpo, " Spiega l'autore principale dello studio Takao Arimori. "La molecola chimerica risultante, Chiusura Fv, era funzionalmente e strutturalmente equivalente al Fv dell'anticorpo originale."
In particolare, il passaggio dal formato Fab al formato Fv-clasp ha notevolmente migliorato la cristallizzazione assistita da anticorpi di due proteine biologicamente importanti, i domini extracellulari integrina a6b1 e sorLasorLA. L'integrina a6b1 svolge un ruolo significativo nell'attaccamento delle cellule iPS e delle cellule ES, nonché di molte cellule del cancro del fegato alla membrana basale, un fondamento della rete proteica extracellulare presente nei tessuti nella maggior parte delle cellule e degli organi, mentre sorLA è un recettore proteico implicato nella malattia di Alzheimer.
"L'applicabilità universale del design della chiusura Fv alla produzione su larga scala ed economica lo rende desiderabile per le applicazioni industriali. Inoltre, la sua elevata stabilità al calore è un grande vantaggio per le immunoterapie, " afferma Junichi Takagi, autore corrispondente. "A parte il campo della biologia strutturale, prevediamo che il design della chiusura Fv contribuirà all'espansione del già eminente uso di anticorpi sia nelle scienze di base che in quelle applicate".