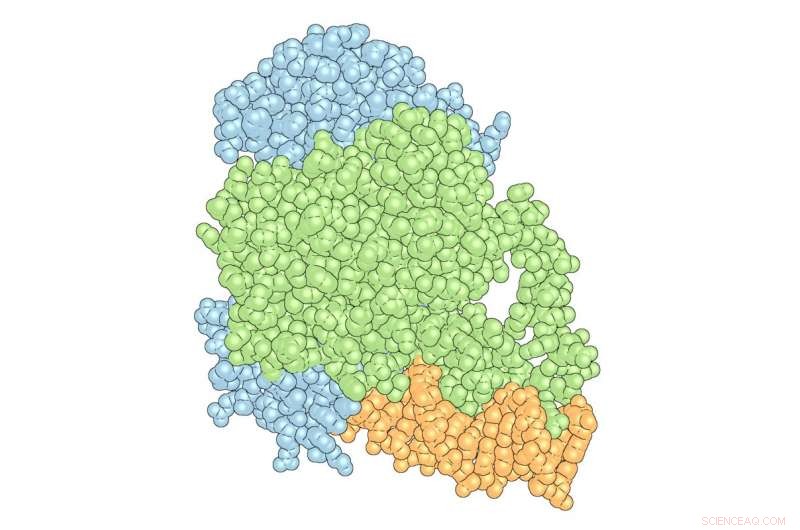
Il 'complesso' di PPARγ (verde) e RXRα (blu) con DNA (arancione). Credito:The Scripps Research Institute
Con le crescenti preoccupazioni per i pericolosi effetti collaterali del popolare farmaco antidiabetico Avandia, ricercatori dello Scripps Research Institute (TSRI) a Giove, Florida, stanno lavorando per capire come le piccole molecole, come quelli di Avandia, può avere effetti così vari in tutto il corpo. Le intuizioni potrebbero aiutare i ricercatori a progettare nuovi farmaci con una migliore efficacia e meno effetti collaterali.
Douglas Kojetin, professore associato al TSRI, e il suo team hanno recentemente pubblicato uno studio in Struttura , mostrando i modi in cui Avandia interagisce e cambia la forma di una combinazione di proteine, recettori e DNA, chiamati "complessi", che determinano gli effetti del farmaco. Oltre ad aiutare a informare la progettazione di futuri farmaci antidiabetici, lo studio ha rivelato che il DNA svolge un ruolo attivo nel determinare la struttura del complesso, una scoperta che ha implicazioni per comprendere come qualsiasi farmaco a piccola molecola influenzi il corpo.
I ricercatori del laboratorio di Kojetin si concentrano sui recettori nucleari, proteine che possono interagire o "legarsi" a entrambi i materiali genetici, come DNA e piccole molecole, oltre a legarsi ad altre proteine chiamate proteine coregolatorie che influiscono sull'espressione genica. Avandia, Per esempio, si lega a PPARγ, un recettore nucleare, che si lega a sequenze di DNA importanti nella regolazione dell'accumulo di grasso e del metabolismo. Ma PPARγ non funziona solo con Avandia. Un secondo recettore nucleare, RXRα, interagisce con PPARγ per formare un "eterodimero", un complesso costituito da due diverse proteine legate insieme che recluta una proteina co-regolatrice chiamata Steroid Receptor Coactivator-2 (SRC-2) per influenzare l'attività di molti geni diversi. Mentre ogni pezzo si lega, il complesso cambia forma, come pezzi di argilla bagnata che si schiacciano insieme per formare una ciotola.
Il team ha cercato di capire in che modo sezioni specifiche del DNA influenzano l'interazione tra il recettore nucleare e la proteina coregolatoria. Per esempio, questo recettore nucleare interagirebbe con la proteina coregolatoria allo stesso modo se non fosse legato al DNA?
Aggiungendo un ulteriore livello di complessità, SRC-2 è una proteina intrinsecamente disordinata, una proteina "flaccida" senza una struttura secondaria coerente che si agita come un noodle di spaghetti sciolti. Ciò significa che i metodi popolari che i ricercatori utilizzerebbero in genere per comprendere la struttura della proteina, come la cristallografia a raggi X, che richiede un campione stabile unflopy, non sarebbe in grado di dire molto agli scienziati su cosa sta facendo questa proteina.
Il team di Kojetin ha utilizzato una combinazione di fattori biochimici quantitativi, metodi biofisici e strutturali in soluzione per formare una comprensione dettagliata di queste interazioni molecolari. Ogni tecnica ha fornito al suo team informazioni che hanno usato per costruire un'immagine di come interagiscono tutte queste molecole.
"Nessuno strumento avrebbe potuto darci la risposta. È stata davvero la combinazione di tutti questi strumenti che ci ha dato un quadro completo di quello che stava succedendo, " ha detto Kojetin.
Si è scoperto che quello che stava succedendo era un meccanismo "termodinamico" mediante il quale il legame al DNA faceva sì che l'eterodimero del recettore cambiasse la sua forma e, soprattutto, stabilizzasse le sue regioni flosce.
Il team di Kojetin ha mostrato che l'interazione del DNA ha avuto un impatto sulla potenza di Avandia e sulla sua capacità di reclutare la proteina coregolatrice. I recettori da soli sono come due palloncini che fluttuano casualmente nel vento, ha spiegato Kojetin. Quando si lega al DNA, i recettori si stabilizzano, come se i palloncini fossero legati insieme, rendendo più facile per SRC-2 interagire con esso.
Se le proteine si fossero legate a un'altra porzione di DNA, il complesso potrebbe essere stato in grado di formare una forma diversa ed esercitare un diverso, effetto forse anche pericoloso, o forse nessun effetto. Diversi geni sono esposti, o accessibile, in diversi tessuti corporei. Questo potrebbe aiutare a spiegare come i farmaci possono avere un effetto in una certa area del corpo e un effetto diverso in altre aree in cui le sezioni di DNA accessibile sono diverse.
"Il farmaco da solo non controlla l'attività nel corpo. Quando il recettore è legato a diverse sequenze di DNA, l'attività del farmaco potrebbe essere modificata." Sapendo questo, disse Kojetin, "Aprirà molte possibilità".